MDC-Forscher entdecken neue Regulationsebene bei wichtigem Protein
Das MDC-Forschungsteam um Dr. Oliver Rocks untersucht Steuerungsmechanismen, die den Umbau des Zellskeletts kontrollieren. Bei einem Screening von Proteinen, die an diesem Prozess beteiligt sind, machten sie eine ungewöhnliche Entdeckung. So beobachteten die Wissenschaftler, dass eines dieser Proteine die katalytische Untereinheit der PKA bindet. „Es hat uns überrascht, diese Untereinheit als Bindungspartner zu finden, denn in der Regel ist für die Signalsteuerung der PKA die regulatorische Untereinheit zuständig“, berichtet der Forscher.
Im klassischen Modell der PKA-Regulation docken die regulatorischen an den katalytischen Untereinheiten an und hindern diese daran, Signale zu senden. Die katalytischen werden von den regulatorischen Untereinheiten nur dann freigegeben, wenn die Zelle ein Signal erhält, das den Spiegel des zellulären Botenstoffs cAMP steigen lässt. cAMP bindet an die regulatorischen Untereinheiten und bringt diese so dazu, die katalytischen Untereinheiten freizugeben.
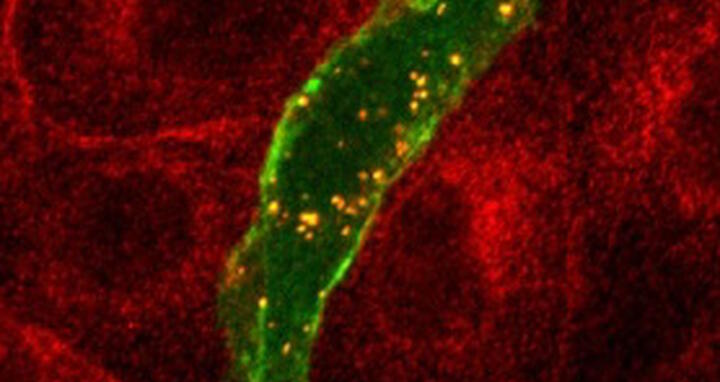
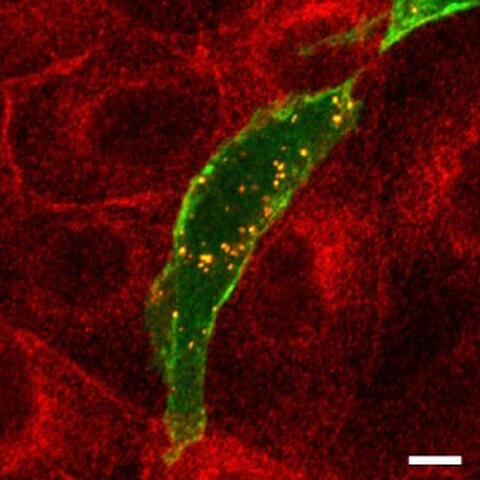
Unter dem Mikroskop: Rot fluoreszierende PKAC und grün fluoreszierendes ARHGAP36 sammeln sich zunächst in kleinen Zellbläschen (erscheinen gelb).
Im Screening band die katalytische Untereinheit der PKA (PKAC) an ein Protein namens ARHGAP36. Dr. Rebecca Eccles hat im Rahmen ihrer Promotion im Labor von Dr. Oliver Rocks untersucht, wie ARHGAP36 mit PKAC interagiert. Sie arbeitete zusammen mit anderen Wissenschaftlern vom MDC sowie Kooperationspartnern der Universität Liverpool. Die Forscherin entdeckte, dass ARHGAP36 die PKAC auf zwei Arten ausschalten kann: zum einen, indem es an sie bindet und ihre Aktivität blockiert, zum anderen indem es sie auf den Weg zu einem der Abfallschredder der Zelle schickt.
Die Aufgabe der PKA in der Zelle ist die Weiterleitung von Signalen, was die katalytische Untereinheit durch die Aktivität der Kinase erledigt – Kinasen hängen ein Phosphat-Molekül an ihre Zielproteine (Substrate). ARHGAP36 hindert die PKAC, ihre Substrate zu binden, ähnlich, wie ein im Schloss steckender Schlüssel das Öffnen der Tür verhindert. Da die PKA in fast allen Geweben vorkommt, wollten die Forscher wissen, wo und wann sie durch ARHGAP36 gehemmt wird. „ARHGAP36 ist ein starker Inhibitor, es ist also wichtig, dass es die PKA nicht einfach überall ausschaltet“, erklärt Dr. Oliver Rocks. Er und sein Team fanden heraus, dass ARHGAP36 nicht ständig in sämtlichen Zellen vorhanden ist – seine Expression ist vielmehr recht eingeschränkt, zum Beispiel auf embryonale Muskelzellen.
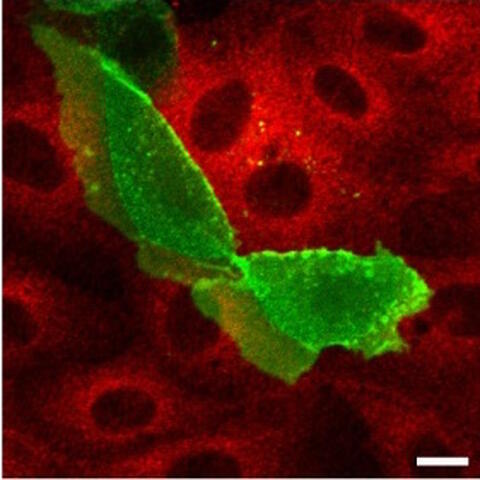
Später verschwand dann die PKAC ganz.
Abnormal viel ARHGAP36 findet sich außerdem bei mindestens einem der vier Subtypen des Medulloblastoms, der am meisten verbreiteten Art von Hirntumoren bei Kindern. Auch beim Neuroblastom, einer weiteren häufigen Krebserkrankung des Nervensystems bei Kindern, ist dieses Protein in den Zellen in unnatürlich hoher Zahl vorhanden. Die genaue biologische Rolle von ARHGAP36 ist noch nicht verstanden, aber es liegt nahe, dass es an der Muskelentwicklung und bei manchen Krebsarten am Tumorwachstum beteiligt ist. So könnten Änderungen im PKA-Signalsystem bei vielen Krebsarten das Tumorwachstum beeinflussen. Zu verstehen, wie Signalwege gesteuert werden, kann auch bei der Medikamentenentwicklung von Nutzen sein. Über diese Wege lassen sich Proteine indirekt angreifen – und so Enzyme blockieren, die sonst schwer erreichbar sind.
Rebecca L. Eccles1, Maciej T. Czajkowski1,2,Carolin Barth1, Paul Markus Müller1, Erik McShane1, Stephan Grunwald1, Patrick Beaudette1, Nora Mecklenburg1, Rudolf Volkmer4, Kerstin Zühlke1, Gunnar Dittmar1, Matthias Selbach1, Annette Hammes1, Oliver Daumke1,5, Enno Klussmann1,6, Sylvie Urbé3, Oliver Rocks1 (2016): „Bimodal antagonism of PKA signalling by ARHGAP3.“ Nature Communications. doi:10.1038/NCOMMS12963
1Max-Delbrück-Center für Molekulare Medizin in der Helmholtz-Gemeinschaft, Berlin; 2Berlin Institute of Health (BIH), Berlin; 3Cellular and Molecular Physiology, Institute of Translational Medicine, University of Liverpool, Liverpool, Vereinigtes Königreich; 4Leibniz-Institut für Molekulare Pharmakologie, Berlin; 5Institut für Chemie und Biochemie, Freie Universität Berlin, Berlin; 6DZHK, Deutsches Zentrum für Herz-Kreislaufforschung, Berlin
Rebecca L. Eccles und Maciej T. Czajkowski haben gleichermaßen zur Arbeit beigetragen.
Kontakt
Vera Glaßer
Leiterin Abteilung Kommunikation (kommissarisch)
Tel: 030/94 06 - 2120
presse@mdc-berlin.de