Chaos im Navigationssystem des Gehirns
Kalium ist unter anderem unentbehrlich für die Erregbarkeit der Muskel- und Nervenzellen. Verschiedene Ionenkanäle sorgen dafür, dass Kaliumionen über Zellmembranen fließen und dadurch elektrische Ströme erzeugen. Vor 20 Jahren konnte das Team von Professor Thomas Jentsch vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) in Berlin die Gene für die Kaliumkanalfamilie KCNQ2-5 identifizieren und später zeigen, dass Mutationen an KCNQ2 und KCNQ3 erblich bedingte Epilepsie beim Menschen verursachen können. Dank dieser wegweisenden Arbeiten konnten Pharmafirmen zielgenaue Antiepileptika entwickeln.
Nun haben ein Team von Molekularbiolog*innen unter Federführung von Thomas Jentsch und ein Team von Neurophysiolog*innen, geleitet von Alexey Ponomarenko (vormals FMP, heute Professor an der Friedrich-Alexander-Universität Erlangen-Nürnberg) zusammen mit Kolleg*innen der University of Connecticut und der Universität zu Köln Hinweise gefunden, dass KCNQ3 möglicherweise auch eine Rolle bei der Alzheimer-Demenz und weiteren kognitiven Störungen spielen könnte.
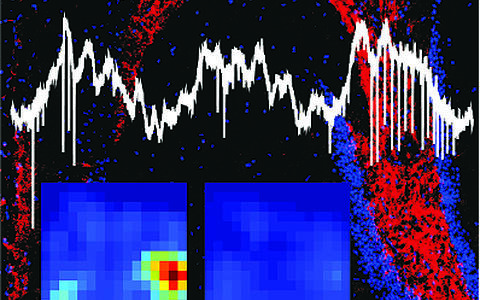
KNCQ3-Immunofluoreszenz im Hippocampus, zeitliche (weiße Signalspuren) und räumliche (Ortsfelder von Salven, links, und von einzelnen Aktionspotenzialen, rechts) Feuerung einer Pyramidenzelle in einer KNCQ3-Knock-Out Maus.
Innere Landkarte des Gehirns
Normalerweise werden bestimmte Kaliumströme vom Botenstoff Acetylcholin gehemmt, was wichtig für die Erregbarkeit in der Hirnrinde und damit entscheidend für Gedächtnis und Aufmerksamkeit ist. Diese cholinerge Neuromodulation geht bei Alzheimer-Patient*innen bekanntlich nach und nach verloren.
In der vorliegenden Arbeit untersuchten die Forschenden die Rolle der KCNQ3-Kanäle speziell bei der Neuromodulation des Navigationssystems des Gehirns. Die sogenannten Ortsfelder („place fields“), deren Entdeckung vor einigen Jahren mit dem Nobelpreis ausgezeichnet wurde, dienen dem Gehirn als innere Landkarte. „Wir fanden heraus, wie verschiedene Signale, die von Ortszellen unter der Kontrolle von KCNQ3-Kanälen erzeugt werden, mit den Gehirnrhythmen interagieren und so präzise räumliche Karten bilden“, beschreibt Alexey Ponomarenko ein zentrales Ergebnis der Studie.
Chaotische Signalübertragung
Das Team von Professor Thomas Jentsch erzeugte genveränderte Mäuse mit defektem KCNQ3-Kanal.
Bei Knock-out-Mäusen mit defektem KCNQ3-Kanal, die von Thomas Jentsch’s Gruppe erzeugt wurden, zeigte sich jedoch ein anderes Bild: Während bei gesunden Mäusen die Aktivitätsmuster der Ortszellen einer bestimmten räumlichen und zeitlichen Abfolge unterlagen, lief bei den Knock-Out-Mäusen die synaptische Übertragung von einzelnen oder mehreren Signalen gleichzeitig (Salven) mehr oder weniger chaotisch ab. „Salven haben normalerweise einen bestimmten Rhythmus, wann sie abgefeuert werden. Bei den Mutanten werden sie jedoch nicht mehr durch den Rhythmus kontrolliert, sondern zu völlig zufälligen Zeitpunkten bzw. Phasen des Rhythmus abgefeuert“, erklärt Ponomarenko. „Dadurch werden einzelne Aktionspotenziale unterdrückt und es kommt zu einem Ungleichgewicht zwischen verschiedenen Aktivitätsmustern in den Nervenzellen.“
15 Mikrometer dünne Silikon-Elektroden, die im Hippocampus der Nager implantiert worden waren, lieferten zusammen mit optogenetischen Untersuchungen die spannenden Einblicke ins Gehirn. Die amerikanischen Kolleg*innen konnten darüber hinaus zeigen, dass der fehlende KCNQ3-Kanal zu einer starken Reduktion der Kaliumströme (hier M-Strom) in den Nervenzellen führte.
Neuer Ansatzpunkt für die Medikamentenforschung
„Obwohl die bisher verfügbaren Daten für eine klinische Anwendung nicht ausreichen, lassen unsere Erkenntnisse vermuten, dass die KCNQ3-Kanäle ein potenzielles Ziel für die zukünftige Erforschung von Medikamenten gegen Alzheimer- und anderen Demenzen sein könnten“, betont Professor Ponomarenko, „zumindest im frühen Stadium, wo die Ortszellen wahrscheinlich noch vorhanden sind, aber die cholinerge Neuromodulation schon nachgelassen hat.“
Weitere Untersuchungen sollen nun folgen, um die Rolle von KCNQ3 im Gehirn noch besser zu verstehen.
Weitere Informationen
- Department Physiology and Pathology of Ion Transport, FMP
- Institute for Physiology und Pathophysiology, Friedrich-Alexander-Universität Erlangen-Nürnberg
Literatur
Xiaojie Gao et al (2021): Place fields of single spikes in hippocampus involve KCNQ3 channel-dependent entrainment of complex spike bursts. Nature Communications, DOI: 10.1038/s41467-021-24805-2
Download
KNCQ3-Immunofluoreszenz im Hippocampus, zeitliche (weiße Signalspuren) und räumliche (Ortsfelder von Salven, links, und von einzelnen Aktionspotenzialen, rechts) Feuerung einer Pyramidenzelle in einer KNCQ3-Knock-Out Maus. © Modified from Gao et al., 2021
Kontakte
Prof. Dr. Alexey Ponomarenko
Institut für Physiologie und Pathophysiologie
Friedrich-Alexander-Universität Erlangen-Nürnberg
Tel.: +49 (0)9131 85 29 30 2
alexey.ponomarenko@fau.de
Prof. Dr. Thomas Jentsch
Department Physiology and Pathology of Ion Transport
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und Max-Delbrück-Centrum für Molekulare Medizin (MDC)
Tel.: +49 (0) 30 94 06 29 61
jentsch@fmp-berlin.de
Silke Oßwald
Öffentlichkeitsarbeit
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP)
Tel.: +49 (0)30 94793 104
osswald@fmp-berlin.de