Abgeschnürt - wie die Zelle Nährstoffe aufnimmt
Dr. Katja Fälber und Prof. Oliver Daumke, Strukturbiologen am Max-Delbrück-Centrum für Molekulare Medizin (MDC) Berlin-Buch haben gemeinsam mit Forschern der Freien Universität (FU) Berlin die molekulare Struktur von Dynamin, einem Drahtzieher der Aufnahme von Nährstoffen in die Zelle entschlüsselt. Da sich auf diese Weise auch Krankheitserreger, wie zum Beispiel AIDS-Viren, ihren Weg in die Körperzellen bahnen, eröffnet das Verständnis des molekularen Mechanismus neue mögliche Ansatzpunkte für medizinische Anwendungen (Nature, DOI: 10.1038/nature10369)*.
Viele Nährstoffe gelangen aus dem Blut über Kanäle in der Zellmembran in die Körperzellen. Doch nicht für alle Nährstoffe gibt es passende Kanäle. So wird beispielsweise Eisen außerhalb der Zelle an ein großes Transportmolekül gebunden und auf einem anderen Weg, der Endozytose, in die Zelle importiert. Dabei lagern sich die beladenen Transportmoleküle an die Zellmembran, diese stülpt sich nach innen und die Eisenmoleküle werden samt ihren Transportern in einem kleinen Membranbläschen (Vesikel) in die Zelle aufgenommen und dort freigesetzt.
Ein wichtiger Drahtzieher der Endozytose ist das Eiweißmolekül Dynamin. Und das im wahrsten Sinne des Wortes: Entsteht ein Vesikel, lagern sich Dynamin-Moleküle aneinander und bilden um den Hals des Vesikels eine Spirale. Dynamin funktioniert wie ein kleiner Motor: Es verbraucht den zelleigenen Kraftstoff GTP und nutzt die Energie, um die Spirale zusammen zu ziehen. Das schnürt den Hals des Vesikels ab, so dass es sich von der Zellmembran löst.
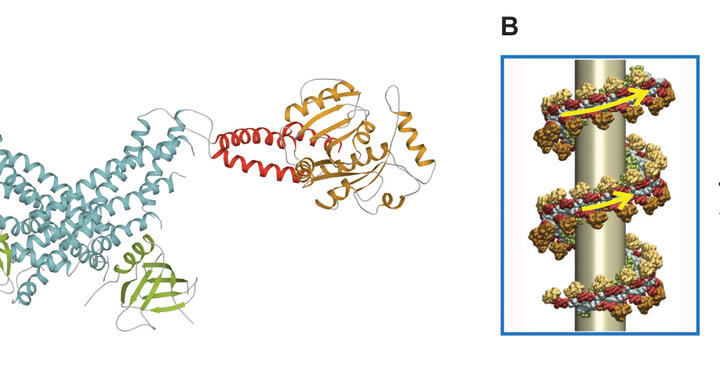
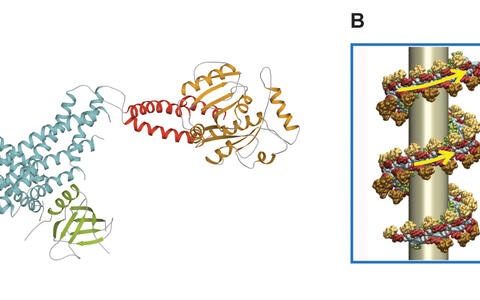
Das Eiweißmolekül Dynamin ist der Drahtzieher, um Nährstoffe in die Zelle zu schleusen. Aber auch Krankheitserreger nutzen diesen Weg in das Zellinnere. (A) Die molekulare Struktur von Dynamin konnte von MDC-Forschern aufgeklärt werden. Stülpt sich die Zellmembran mit den angelagerten Transportmolekülen nach innen, ein Vorgang, der als Endozytose bezeichnet wird, lagert sich Dynamin um den Hals des Bläschens (B) und schnürt - angetrieben von dem zelleigenen Kraftstoff GTP - das Membranbläschen ab. (Graphik: Dr. Katja Fälber und M.Sc. Bioinf. Martin Held/Copyright: MDC)
Die molekularen Details dieses Zugmechanismus um den Vesikelhals waren bislang ungeklärt. Die Strukturbiologen Prof. Daumke und Dr. Fälber vom MDC sowie der Endozytose-Forscher Prof. Volker Haucke und der Bioinformatiker Dr. Frank Noé von der FU Berlin liefern mit ihrer aktuellen Studie jetzt eine wichtige Grundlage, um diesen Vorgang besser zu verstehen. Es gelang ihnen erstmalig mit Hilfe der Röntgenstrukturanalyse, ein Strukturmodell von Dynamin zu entwickeln. Für diese Untersuchung war es nötig, Proteinkristalle von Dynamin herzustellen. Dazu haben sich die Forscher die Erkenntnisse ihrer vorherigen Studie zu einem mit Dynamin verwandten Protein zu Nutze gemacht. Aus dem Röntgen-Streubild dieser Kristalle konnten die Forscher dann ein detailliertes Bild von Dynamin ableiten. „Jetzt, da wir eine Idee davon haben, wie das Dynamin-Molekül aufgebaut ist, können wir erstmals auf atomarer Ebene verstehen, wie der molekulare Motor Dynamin läuft“, erläutert Prof. Daumke.
Neben der Aufnahme von Nährstoffen ist die Endozytose auch bei der Weiterleitung von Signalen zwischen benachbarten Nervenzellen sowie für das Immunsystem essentiell. Auf diese Weise verleiben sich zum Beispiel Fresszellen Krankheitserreger ein und machen sie unschädlich. Prof. Daumke: „Aber auch Krankheitserreger wie HIV und Influenza Viren machen sich die Endozytose zunutze, um in unsere Körperzellen zu gelangen und sich dort auszubreiten. Daher ist es wichtig, den molekularen Zugmechanismus von Dynamin während der Endozytose noch besser zu verstehen. Dann können wir mögliche Ansatzpunkte für medizinische Anwendungen finden – gerade auch für Patienten mit Muskel- und Nervenerkrankungen, die im Zusammenhang mit Mutationen im Dynamin-Gen stehen.“ In künftigen Forschungsprojekten, die von der Deutschen Forschungsgemeinschaft im Rahmen von Sonderforschungsbereichen (SFB740 und SFB958) gefördert werden, wollen die MDC-Forscher Dynamin daher noch genauer unter die Lupe nehmen. Sie möchten herausfinden, welche Strukturveränderungen Dynamin vollzieht, wenn der Zellkraftstoff GTP an das Protein bindet und der Zugmechanismus am Vesikelhals in Gang gesetzt wird.
*Crystal structure of nucleotide-free dynamin
Katja Faelber1, York Posor2#, Song Gao1,2#, Martin Held3#, Yvette Roske1#, Dennis Schulze1, Volker Haucke2, Frank Noé3 & Oliver Daumke1,4
1Crystallography, Max-Delbrück-Centrum for Molecular Medicine, Robert-Rössle-Straße 10, 13125 Berlin, Germany.
2Institute for Chemistry and Biochemistry, Freie Universität Berlin, Takustraße 6, 14195 Berlin, Germany.
3Institute for Mathematics, Freie Universität Berlin, Arnimallee 6, 14195 Berlin, Germany.
4Institute for Medical Physics and Biophysics, Charité, Ziegelstraße 5-9, 10117 Berlin, Germany.
#These authors contributed equally to this work.
Barbara Bachtler
Pressestelle
Max-Delbrück-Centrum für Molekulare Medizin (MDC) Berlin-Buch in der Helmholtz-Gemeinschaft
Robert-Rössle-Straße 10
13125 Berlin
Tel.: +49 (0) 30 94 06 - 38 96
Fax: +49 (0) 30 94 06 - 38 33
e-mail: presse@mdc-berlin.de
http://www.mdc-berlin.de/