Zwei Experimente auf einen Streich
Wer herausfinden will, ob zwei Proteine aneinander binden, hat die Qual der Wahl und kann fast aus einem Dutzend unterschiedlicher Verfahren wählen. Doch ein Assay kann besser geeignet sein als ein anderer. Das hängt zum Beispiel von Stärke und Dauer der Wechselwirkung und von den jeweiligen Umgebungsbedingungen ab. „Leider lässt sich mit jeder Methode nur ein Teil sämtlicher Protein-Protein-Interaktionen messen“, sagt Professor Erich Wanker. „Das ist jeweils nur ein kleiner Ausschnitt aus dem Gesamtbild.“
Zusammen mit seinem Postdoktoranden Philipp Trepte ist es dem Biochemiker nun gelungen, mehrere solcher Teilausschnitte zu einer Panaroma-Ansicht zusammenzufügen. Im Fachblatt Molecular Systems Biology stellten sie einen Versuchsaufbau namens „LuTHy“ vor. Er vereint zwei etablierte, sich gegenseitig ergänzende Messmethoden in einem Experiment. Das kombinierte Verfahren erkennt schwache und starke, sowie direkte und indirekte Interaktionen zwischen Proteinen. Andere Methoden sagen nur aus, ob eine Bindung überhaupt stattgefunden hat – LuTHy beurteilt die Stärke der Bindung. Zudem überlappen die Befunde der beiden Teilexperimente, was das Ergebnis insgesamt verbessert.
Zwei Eiweiße sorgen für Erleuchtung
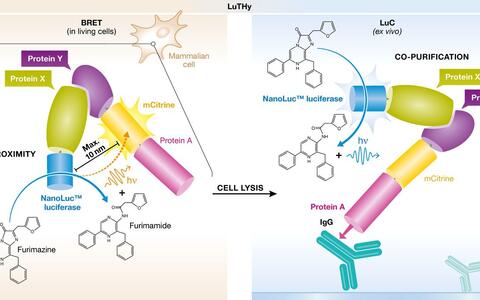
Wie alle Two-Hybrid-Verfahren arbeitet auch LuTHy mit zwei Fusionsproteinen. Zuerst wird das fluoreszierende mCitrine und ein Protein-A-Tag mit dem fraglichen Protein fusioniert. Dieser Teil des Systems ist der „Köder“, die „Beute“ ist der potenzielle Bindungspartner. Dieser erhält ein Enzym, das Licht produziert, eine Luziferase.
Nur, wenn sich beide Proteine sehr nah beieinander befinden, überträgt die Luziferase Energie auf das fluoreszierende mCitrine, das dadurch Strahlung mit längerer Wellenlänge abgibt. Das klappt sogar in lebenden Zellen durch „Bioluminiszenz-Resonanzenergietransfer“ (BRET). Dieser Teil des Verfahrens misst schwache oder kurzlebige Interaktionen, die nur in der natürlichen Umgebung der Proteine auftreten.
Der zweite Teil des Verfahrens reißt die Proteine aus ihrer natürlichen Umgebung. Nur relativ starke Wechselwirkungen überstehen die Prozedur, bei der die Zellen aufgebrochen werden und das fluoreszierende „Köder“-Fusionsprotein über den Protein-A-Tag an eine Unterlage gebunden wird. Wenn „Beute“-Proteine anbeißen, haben diese eine Luziferase im Huckepack, deren Aktivität sich leicht bestimmen lässt. Bei der „Luminiszenz-basierten Detektion bei Ko-Präzipitation“ wird die fluoreszierende Komponente mCitrine nicht mehr gebraucht und die Distanz zwischen beiden künstlichen Lichterzeugern ist unerheblich. Anders als bei BRET werden deshalb auch jene Interaktionen sichtbar, bei denen die Partner weiter voneinander entfernt sind, etwa in Proteinkomplexen sitzen oder durch Adapterproteine getrennt sind.
Eine Methode mit Potenzial
„LuTHy hilft, die jeweiligen Schwächen der individuellen Verfahren gegeneinander auszuspielen“, schreibt der Wissenschaftler Mikko Taipale in einem begleitenden Kommentar. „Die Methode ist quantitativ, skalierbar, kompatibel mit der Behandlung mit kleinen Molekülen, funktioniert unter diversen Bedingungen und nutzt zwei verschiedene Messmethoden für die Detektion.“ Auch Philipp Trepte ist zufrieden: „Wir haben so etwas wie einen neuen Standard geschaffen. Damit werden auch Ergebnisse verschiedener Arbeitsgruppen besser vergleichbar.“
Besonders interessant findet Wanker die Anwendung der Methode: „Wir können beurteilen, wie sich Mutationen auf die Interaktionen zwischen Proteinen und die Entstehung von Krankheiten auswirken.“ Eine solche Genveränderung könne etwa aus einer starken eine schwache Bindung machen und viel Unheil in der Zelle anrichten. „Wenn wir nun einen Wirkstoff mit dem Assay testen und sehen, dass die Interaktion wieder stark ist, haben wir einen Ansatz für ein neues Medikament.“
Literatur
Philipp Trepte et al. (2018): „LuTHy: a double‐readout bioluminescence‐based two‐hybrid technology for quantitative mapping of protein–protein interactions in mammalian cells.“ Molecular Systems Biology 14, e8071. (Open Access) doi:10.15252/msb.20178071
Mikko Taipale (2018): „News & Views: Two protein/protein interaction assays in one go.“ Molecular Systems Biology 14, e8485. (Open Access) doi:10.15252/msb.20188485