Molekulare Reporter stellen Verbündete des Hirntumors bloß
Das Glioblastom ist der häufigste bösartige Hirntumor bei Erwachsenen. Jährlich erkranken daran etwa fünf von 100.000 Menschen. Die Diagnose kommt einem Todesurteil gleich: Auch nach einer Resektion mit anschließender Bestrahlung und Chemotherapie sterben die Patient*innen innerhalb weniger Monate. Denn nach der Behandlung kehrt ein Glioblastom zurück. Ohne Ausnahme und aggressiver als vorher.
Bei Untersuchungen des Tumorgewebes finden Forscher*innen immer auch Immunzellen im Inneren des Glioblastoms. Sie vermuten deshalb schon seit langem, dass diese den Tumor stärken, anstatt ihn zu bekämpfen. Ein Team um Dr. Gaetano Gargiulo am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) hat nun den eindeutigen Beweis dafür geliefert. “Wir haben eine neue Technologie entwickelt, mit der wir auf molekularer Ebene sichtbar machen können, wie die körpereigenen Immunzellen die Tumorzellen anstelle des Körpers verteidigen“, sagt Gargiulo.
Wir haben eine neue Technologie entwickelt, mit der wir auf molekularer Ebene sichtbar machen können, wie die körpereigenen Immunzellen die Tumorzellen anstelle des Körpers verteidigen.
Dafür kreieren die Forscher*innen molekulare Reporter, die in einer Zelle Fluoreszenz erzeugen, wenn dort komplexe Programme, beispielsweise die Veränderung der Zellidentität, ablaufen. Ihre Forschungsergebnisse haben sie im Fachjournal Cancer Discovery veröffentlicht. Erstautoren sind Matthias Jürgen Schmitt, Carlos Company und Yuliia Dramaretska, Doktorand*innen in Gargiulos AG „Molekulare Onkologie“. Die Gruppe hat mit Wissenschaftler*innen des Niederländischen Krebsinstituts, der Ludwig-Maximilians-Universität München und des Spanischen Krebsforschungszentrums zusammengearbeitet.
Das Glioblastom, früher auch Glioblastoma multiforme genannt, ist ein sehr vielgestaltiger Tumor. Medikamente, die erfolgreich gegen einige Arten von Darm- oder Brustkrebs eingesetzt werden, sind gegen das Glioblastom machtlos. „Das liegt zum einen daran, dass die meisten Krebsmedikamente es gar nicht erst schaffen, die Blut-Hirn-Schranke zu überwinden“, erklärt Gargiulo. Die Blut-Hirn-Schranke ist ein komplexes Gefüge aus zellulären und molekularen Kanälen, die den Zufluss von Stoffen aus dem Blutstrom ins Hirngewebe regulieren. Es lässt Substanzen, die nicht ins zentrale Nervensystem gehören, nicht passieren. Wahrscheinlich gibt es aus diesem Grund bislang nur ein einziges Medikament für die Chemotherapie bei Glioblastom-Patienten. Und dieses Medikament ist nicht besonders wirkungsvoll.
Basis für die Entwicklung neuer Medikamente
Ein besseres Verständnis der Glioblastom-Subtyp-Identitäten und der Trigger, die diesen Veränderungsprozess auslösen, könnte einen Anhaltspunkt für die Entwicklung neuer, effektiverer Therapien liefern.
Zum anderen ist Krebszelle nicht gleich Krebszelle. Die Zellen, aus denen ein Glioblastom besteht, werden in verschiedene molekulare Subtypen unterteilt. Die Zusammensetzung ändert sich im Laufe der Zeit. Insbesondere bei einem Rezidiv – also einem Tumor, der nach einer Behandlung erneut auftritt – findet häufig eine Verwandlung statt: hin zum aggressivsten Zelltyp, der noch tödlicher ist als die anderen. „Ein besseres Verständnis der Glioblastom-Subtyp-Identitäten und der Trigger, die diesen Veränderungsprozess auslösen, könnte einen Anhaltspunkt für die Entwicklung neuer, effektiverer Therapien liefern“, sagt Matthias Schmitt.
Voraussetzung dafür ist, die Biologie des Tumors genau zu verstehen. Wie er sein Wachstum reguliert und mit umliegenden Zellen interagiert. Gargiulo und seine Mitstreiter*innen haben jetzt das Werkzeug gefunden, mit dem sie diese zellulären Prozesse nachvollziehen können. „Wir haben im Genom der Tumorzellen die Regulatoren identifiziert, die den jeweiligen Subtyp der Zellsignatur programmieren“, beschreibt Yuliia Dramaretska. „Diese kurzen DNA-Abschnitte haben wir zu molekularen Reportern umgewandelt, die fluoreszieren, wenn sich die Zellen verwandeln.“ Sie zeigen auch an, was diese Verwandlung auslöst: beispielsweise Immunzellen, Medikamente oder ionisierende Strahlen.
Vielfältige Einsatzmöglichkeiten
„Mithilfe der molekularen Reporter können wir nun herausfinden, wie wir die Immunzellen davon abhalten können, die Tumorzellen so zu verändern, dass sie aggressiver werden“, beschreibt Gargiulo künftige Forschungsansätze. „Vielleicht können wir sie auch dazu bringen, weitere Immunzellen gezielt zu rekrutieren, damit sie den Tumor mitbekämpfen.“
Die Technologie ist bereits patentiert. Um sie weiter zu entwickeln, soll ein Unternehmen ausgegründet werden. „Ihre Anwendung ist nicht auf Glioblastome beschränkt“, betont Carlos Company, „sie ist potenziell anwendbar in vielen biologischen Systemen.“ Ganz aktuell könnte sie in der Forschung zu COVID-19 eingesetzt werden, führt Gargiulo aus. MDC-Wissenschaftler*innen wollen auf dieser Grundlage Tests entwickeln, die sehr frühzeitig anzeigen, ob das Virus das Lungengewebe angreift. Sie könnten Medikamentenkombinationen dahingehend überprüfen, ob sie den Erreger davon abhalten, sich in den Zellen zu replizieren, und eine antivirale Reaktion auslösen. Die Methode könnte auch Aufschluss darüber geben, wie und warum Medikamente gegen COVID-19 wirken.
Weiterführende Informationen
Bild zum Download
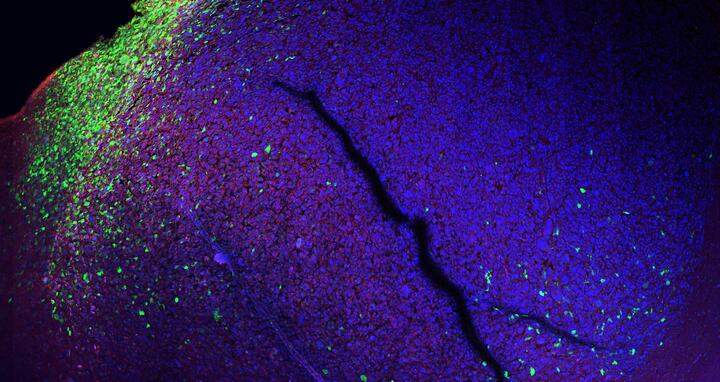
"Bisher nur vermutet, jetzt dank des molekularen Reporters sichtbar gemacht: Wo menschliche Tumorzellen und Gehirnzellen einer Maus aufeinandertreffen, haben die Tumorzellen eine andere Identität als überall sonst (grün)." © AG Gargiulo, MDC
Literatur
Matthias Jürgen Schmitt, Carlos Company, Yuliia Dramaretska et al (2020): Phenotypic mapping of pathological crosstalk between glioblastoma and innate immune cells by synthetic genetic tracing, DOI: 10.1158/2159-8290.CD-20-0219
Pressekontakte
Dr. Gaetano Gargiulo
Leiter der Arbeitsgruppe „Molekulare Onkologie“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
gaetano.gargiulo@mdc-berlin.de
Jana Ehrhardt-Joswig
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
jana.ehrhardt-joswig@mdc-berlin.de oder presse@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.