COVID-19: Was die Lawine der Entzündung antreibt
Zelluläre Seneszenz ist ein Gewebe-Schutzprogramm bei Stress und drohender Schädigung: Als programmierter Zellteilungsstopp bewahrt sie den menschlichen Körper davor, dass Krebs entsteht. Seneszente Zellen sondern außerdem entzündungsfördernde Botenstoffe ab, die für Prozesse wie die Wundheilung wichtig sind. Im Übermaß oder dauerhaft produziert fördern diese Entzündungsvermittler allerdings altersbedingte Krankheiten wie Diabetes oder Gefäßverkalkung. Wenig beachtet waren bisher einzelne Hinweise, dass auch eine virale Infektion Seneszenz auslösen kann.
Wie ein Forschungsteam der Charité – Universitätsmedizin Berlin, des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), der Johannes Kepler Universität (JKU) Linz und des Kepler Universitätsklinikums (KUK) um den Onkologen Professor Clemens Schmitt in „Nature“ zeigt, trägt dieser Prozess maßgeblich zu der lawinenartigen Entzündungskaskade bei, die Lungenschäden bei COVID-19 verursacht. Wirkstoffe, die seneszente Zellen gezielt entfernen, mildern COVID-19-Lungenschäden und das Ausmaß der Entzündung im Tiermodell deutlich ab. „Diese entzündliche Überreaktion frühzeitig mit spezifischen Wirkstoffen zu unterbrechen, hat in unseren Augen großes Potenzial, eine neue Strategie zur Behandlung von COVID-19 zu werden“, sagt der Krebsmediziner.
Infektion treibt Schleimhautzellen in die Seneszenz
Clemens Schmitt ist Direktor des Molekularen Krebsforschungszentrums (MKFZ) der Charité und leitet die Forschungsgruppe „Tumorgenetik und zelluläre Stressantworten“ am MDC sowie eine Forschungsgruppe an der Medizinischen Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie am Charité Campus Virchow-Klinikum. Er ist Vorstand der Universitätsklinik für Hämatologie und Internistische Onkologie am KUK und Lehrstuhlinhaber an der JKU Linz. Seine langjährige Expertise auf dem Gebiet der Seneszenz, vor allem bei Tumorzellen, nutzte er nun, um COVID-19 zu erforschen. In Zell- und Tiermodellen sowie an Gewebeproben von COVID-19-Patientinnen und -Patienten untersuchten er und sein Team, welche Rolle Seneszenz für die Immunreaktion nach einer SARS-CoV-2-Infektion spielt.
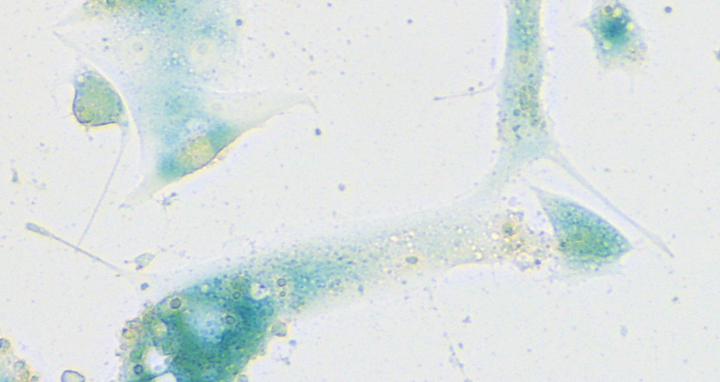
Zellen der menschlichen Nasenschleimhaut, die infolge einer SARS-CoV-2-Infektion das Seneszenzprogramm gestartet haben. Angefärbt wurden sie mit einem Standard-Nachweisverfahren für Seneszenz, das eine typische Blaufärbung erzeugt.
Wie die Wissenschaftlerinnen und Wissenschaftler zeigen, leitet das zelluläre Stressprogramm eine lawinenartige Entzündungsreaktion ein, an deren Ende die COVID-19-typische Lungenentzündung steht. Die Kaskade beginnt – vereinfacht gesagt – in den mit SARS-CoV-2 infizierten Zellen der oberen Atemwege. Entert das Virus die Schleimhautzellen, lösen diese als Stressreaktion ihr Seneszenz-Programm aus. Die seneszenten Schleimhautzellen produzieren dann eine Fülle entzündungsfördernder Botenstoffe, die wiederum bestimmte Immunzellen, die Makrophagen, anlocken.
Die Makrophagen wandern in die Schleimhäute ein, um die seneszenten Zellen zu beseitigen. Durch die Botenstoffe werden sie jedoch selbst in einen seneszenten Zustand versetzt und schütten ihrerseits große Mengen an Entzündungsbotenstoffen aus. Die Immunzellen können in die Lunge gelangen und dort weitere Zellen in die Seneszenz treiben – beispielsweise die besonders empfindlichen Zellen, die die kleinen Blutgefäße der Lunge auskleiden. Das veranlasst die Blutgefäß-Zellen unter anderem, blutverklumpende Stoffe abzugeben. Mikrothrombosen entstehen, das heißt, dass die kleinen Blutgefäße in der Lunge verstopfen. Der Sauerstoffaustausch in der Lunge wird dadurch wesentlich behindert.
Die Kaskade frühzeitig unterbrechen
„Offenbar ist das zelluläre Stressprogramm der Seneszenz ein sehr wichtiger Treiber eines Entzündungssturms, der eine Vielzahl charakteristischer Merkmale der COVID-19-Lungenentzündung, wie Gefäßschädigungen oder Mikrothrombosen, maßgeblich verursacht“, erklärt Dr. Soyoung Lee, Erstautorin der Studie und Wissenschaftlerin am MDC und an der Medizinischen Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie sowie dem MKFZ am Charité Campus Virchow-Klinikum. „Da lag es nahe zu prüfen, ob wir den Verlauf der Erkrankung abmildern können, wenn wir die durch das Virus seneszent gewordenen Zellen frühzeitig attackieren.“
Das Team untersuchte im Tiermodell den Effekt von vier Wirkstoffen, die gezielt seneszente Zellen angreifen: Navitoclax, Fisetin, Quercetin und Dasatinib. Zwei dieser Senolytika sind pflanzliche Wirkstoffe, zwei werden für die Krebstherapie genutzt bzw. getestet. Alle vier Substanzen – zum Teil allein, zum Teil in Kombination – waren bei Hamstern und Mäusen in unterschiedlichem Maße in der Lage, den Entzündungssturm zu normalisieren und die Lungenschädigung abzuschwächen. Das Forschungsteam konnte auch auf Daten von zwei kleineren klinischen Studien zurückgreifen, die bereits abgeschlossen sind. Die kombinierte Auswertung deutet an, dass eines der Senolytika auch beim Menschen die Wahrscheinlichkeit eines schweren COVID-19-Verlaufs senken konnte.
Klinische Studien prüfen Dosis und Nebenwirkungen
Wie alle Wirkstoffe können die Senolytika aber Nebenwirkungen haben. Bevor man sie für eine Behandlung von COVID-19 in Betracht ziehen könnte, sind deshalb noch viele Fragen zu klären.
„Diese Ergebnisse sind sehr ermutigend“, sagt Schmitt, der auch Wissenschaftler des Deutschen Konsortiums für Translationale Krebsforschung (DKTK) ist. „Wie alle Wirkstoffe können die Senolytika aber Nebenwirkungen haben. Bevor man sie für eine Behandlung von COVID-19 in Betracht ziehen könnte, sind deshalb noch viele Fragen zu klären: Welche Dosis ist wirksam? Wann und für wie lange müssten die Substanzen verabreicht werden? Welche Nebenwirkungen sind damit verbunden? Und könnten ältere Menschen mehr als jüngere von den Senolytika profitieren? Denn mit dem Älterwerden stehen zunehmend mehr Zellen kurz vor dem Eintritt in die Seneszenz. Dazu sind weitere klinische Studien nötig, die verschiedene Institutionen weltweit zum Teil schon aufgesetzt haben.“
Die Forschenden sehen den Ergebnissen dieser klinischen COVID-19-Studien mit großem Interesse entgegen. Gleichzeitig blicken sie über die aktuelle Pandemie hinaus. „Unsere Studie hat gezeigt, dass verschiedene Zelltypen nicht nur nach einer Infektion mit SARS-CoV-2, sondern auch mit ganz anderen Viren Seneszenz auslösen“, erklärt Dr. Lee. „Wir hoffen deshalb, dass unsere Erkenntnisse auch für andere Infektionskrankheiten relevant sind, bei denen die Immunreaktion für den Krankheitsverlauf eine große Rolle spielt.“
Gemeinsame Pressemitteilung der Charité, des MDC, der JKU Linz und des KUK
Weiterführende Informationen
- Corona-Forschung am MDC
- Molekulares Krebsforschungszentrum der Charité
- Medizinische Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie (CVK)
- Johannes Kepler Universität Linz
- Kepler Universitätsklinikum
Literatur
Lee S, Yong Y et al. (2021): „Virus-induced senescence is driver and therapeutic target in COVID-19“. Nature, DOI: 10.1038/s41586-021-03995-1
Foto zum Download
Zellen der menschlichen Nasenschleimhaut, die infolge einer SARS-CoV-2-Infektion das Seneszenzprogramm gestartet haben. Angefärbt wurden sie mit einem Standard-Nachweisverfahren für Seneszenz, das eine typische Blaufärbung erzeugt. Foto: Charité | Soyoung Lee
Kontakte
Prof. Dr. Clemens Schmitt
Leiter der Arbeitsgruppe „Tumorgenetik und zelluläre Stressantworten“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Charité – Universitätsmedizin Berlin (CVK)
+49 30 450 553 292
clemens.schmitt@charite.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406 2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
Max-Delbrück-Centrum für Molekulare Medizin (MDC)
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.