Wie Mitochondrien in Form bleiben
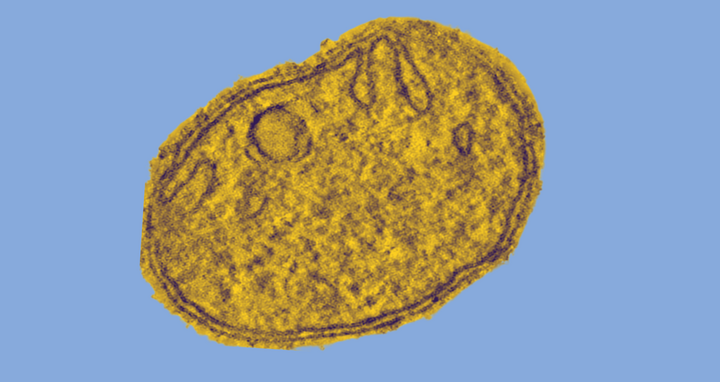
Mitochondrien sind die Zellkraftwerke nahezu aller Lebewesen, die einen Zellkern besitzen. Sie produzieren den universellen Energiespeicher der Zelle: Adenosintriphosphat (ATP). Je nach Energiebedarf kann eine einzelne Zelle bis zu einigen Tausend Mitochondrien enthalten. Besonders viele dieser winzigen Organellen finden sich in Nerven-, Muskel- und Eizellen.
Man nimmt an, dass Mitochondrien bis vor rund zwei Milliarden Jahren aus eigenständigen Bakterien hervorgegangen sind, die in Symbiose mit anderen Bakterien lebten. Sie haben ein eigenes, ringförmiges Genom und eine doppelte Membran. Während die äußere Membran einen langgezogenen Schlauch ausbildet, ist die innere aufwendig gefaltet und hat zahlreiche langgezogene Einstülpungen (Cristae), die an die Finger eines Handschuhs erinnern. Diese Hohlräume sind unter anderem die Produktionsstätten des ATP.
Wir liefern nun erstmals ein molekulares Modell dafür, wie Crista Junctions ihre Form fixieren.
Bislang war wenig darüber bekannt, wie die innere mitochondriale Membran ihre typische Form bewahren kann – vor allem die stark gekrümmte Halsregion der Cristae, die Crista Junctions. Sie sind besonders wichtig, weil sie die Passage von Stoffen in und aus dem Hohlraum regulieren. „Wir liefern nun erstmals ein molekulares Modell dafür, wie Crista Junctions ihre Form fixieren“, sagt Professor Oliver Daumke, einer der zwei Letztautoren und Leiter einer Arbeitsgruppe am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC). Mitochondrien sind ein Paradebeispiel dafür, wie Membranform und -funktion zusammenspielen, schreiben die Forschenden aus Berlin, Hamburg, Göttingen und Halle in „Science Advances“. Fehlerhaft gebaute Mitochondrien-Membranen können zu neurodegenerativen und muskulären Erkrankungen führen: Defekte am Protein Mic60, welches maßgeblich an der Formgebung von Crista Junction beteiligt ist, stehen beispielsweise in Zusammenhang mit Morbus Parkinson.
Filigranes Proteingewölbe
„Wir haben Teile der Proteine von Mic60 und Mic19 mit Hilfe von Bakterien biosynthetisch hergestellt und Kristalle daraus gezüchtet, um die Strukturen im Detail sichtbar machen zu können. Am Synchrotron in Berlin-Adlershof (BESSY II) wurden diese dann mit Röntgenstrahlung beschossen, um die 3D-Struktur zu bestimmen“, erklärt Dr. Tobias Bock-Bierbaum, der gemeinsam mit Dr. Kathrin Funck Erstautor der Studie ist.
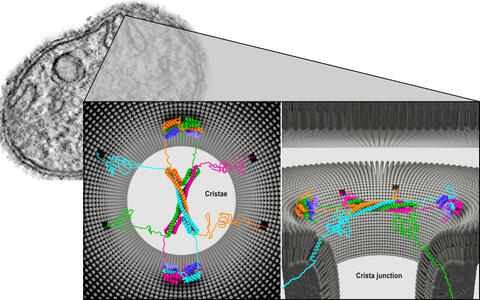
Architektur des Mic60-Mic19-Komplexes an den Crista Junctions (links: Vogelperspektive; rechts: Seitenansicht).
Ähnlich aufgebaut wie die Streben eines gotischen Kreuzgewölbes, könnte dieses Gerüst aus Proteinen komplett den Hals des Membranhohlraums an der Crista Junction überspannen: Dort sitzt offenbar ein Komplex aus je vier Mic60- und vier Mic19-Proteinen.
Wir haben Teile der Proteine von Mic60 und Mic19 mit Hilfe von Bakterien biosynthetisch hergestellt und Kristalle daraus gezüchtet, um die Strukturen im Detail sichtbar machen zu können.
Die Mic60-Moleküle sind zu langestreckten Spiralen verdrillt. Je zwei Proteine liegen antiparallel nebeneinander – und überkreuz mit dem anderen Paar. Jeweils zwei Enden werden von zwei Mic19-Proteinen flankiert und somit wie ein Schloss zusammengehalten. Das Proteingewölbe ist zudem sehr dynamisch: Es kann zerfallen und sich erneut aufbauen.
Oliver Daumke war überrascht, wie perfekt sich die im Labor hergestellten Proteine im Reagenzglas arrangierten. „Wir vermuten, dass der gesamte Komplex wie ein Molekularsieb den Ein- und Austritt von Substanzen in die Cristae reguliert, möglicherweise abhängig von der Molekülgröße.“ Diese Struktur sitzt demnach wie eine poröse Gummikappe auf einem Flaschenhals.
Das „Molekularsieb“ ist so winzig, dass es in Zellen selbst mit dem besten Elektronenmikroskop nicht klar erkennbar ist. Aber ein indirekter Nachweis ist möglich. „Wenn die Architektur des Protein-Komplex, von dem wir bisher nur Teilstücke im Reagenzglas hergestellt haben, wirklich entscheidend für die Stabilisierung der Crista Junctions ist, müsste sich die Form der inneren Mitochondrien-Membran verändern, sobald eines der Proteine fehlerhaft ist“, erklärt Bock-Bierbaum.
In vivo-Nachweis an Hefezellen
Die Autor*innen des Papers von links nach rechts: Tobias Bock-Bierbaum, Kathrin Funck, Oliver Daumke
Dies testeten Mitarbeitende des Projektpartners Professor Martin van der Laan von der Universität des Saarlandes (Homburg/Saar) an lebenden Zellen, indem sie bestimmte Aminosäuren im Mic60 der Hefe Saccharomyces cerevisiae austauschten. Das Resultat war eindeutig: Die Crista Junctions fielen zusammen. „Die Hohlräume waren zwar noch vorhanden, aber sie hatten sich quasi abgeschnürt und befanden sich im Inneren von zwei glatten, runden Membranschichten“, sagt Bock-Bierbaum.
Als nächstes wollen die Forschenden die Dynamik der Barriere genauer untersuchen und versuchen, das gesamte Proteingewölbe herzustellen. Außerdem bleibt noch die Frage, wie Defekte an der Struktur entstehen, die Krankheiten auslösen. Es gäbe beispielsweise einen zellulären Regulator, der mit Morbus Parkinson in Zusammenhang steht, erzählt Oliver Daumke. „Wir wollen jetzt untersuchen, ob und wenn ja, wie er einen Einfluss auf die Architektur des Mic60-Proteinkomplexes hat.“
Text: Catarina Pietschmann
Weiterführende Informationen
Literatur
Bock-Bierbaum et al. (2022): „Structural insights into crista junction formation by the Mic60-Mic19 complex“. Science Advances, DOI: 10.1126/sciadv.abo4946.