AG Daumke
Strukturbiologie Membran-assoziierter Prozesse
Profil
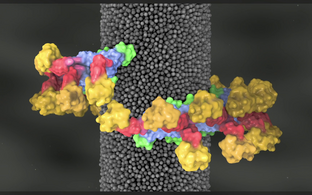
Diese künstlerische Darstellung zeigt die Abschnürung Clathrin-bedecker Vesikel durch die molekulare Maschine Dynamin. Unsere Arbeitsgruppe konnte die Struktur von Dynamin aufklären und nachweisen, wie sich Dynamin in helikalen Strukturen um den Vesikelhals anlagert. Mit Hilfe der strukturellen Daten entwickelten wir ein Modell, wie sich die Schlinge in einer Energie-getriebenen Reaktion zusammenzieht und den Vesikelhals abschnürt.
Eine Fehlfunktion molekularer Maschinen kann zu verschiedenen Erkrankungen führen, wie zum Beispiel zu Muskeldystrophien oder neuronalen Fehlfunktionen. Unsere Forschung trägt dazu bei, die molekularen Grundlagen solcher Erkrankungen zu verstehen und ggf. neue Therapien zu entwickeln.
Eine ausführliche Beschreibung unserer Projekte finden Sie auf den englisch-sprachigen Seiten.
Team
Veröffentlichungen
Nachrichten
Unterrichtsmaterial
Sie finden diverses Unterrichtsmaterial (in Deutsch) von uns und anderen Gruppen des Sonderforschungsbereich 958 hier: