Was ApoE4 fürs Gehirn gefährlich macht
Apolipoprotein E (ApoE) ist so etwas wie ein Lieferservice für das menschliche Gehirn. Es versorgt die Nervenzellen mit wichtigen Nährstoffen, unter anderem mit mehrfach ungesättigten Fettsäuren – Bestandteile der Membranen, die die Nervenzellen umhüllen. Außerdem werden bestimmte ungesättigte Fettsäuren in Endocannabinoide umgewandelt. Das sind körpereigene Botenstoffe, die zahlreiche Funktionen des zentralen Nervensystems regulieren, etwa das Gedächtnis oder die Steuerung der Immunantwort, und sie schützen das Gehirn vor Entzündungen.
Warum ApoE4 das Alzheimerrisiko so stark erhöht, ist eine der zentralen Fragen in der Alzheimerforschung.
Die ApoE-Ladung gelangt über Sortilin, einen Membran-Rezeptor, in die Nervenzellen: Sortilin bindet ApoE und transportiert es über eine Einstülpung der Zellmembran in das Innere der Nervenzelle. Dieser Vorgang heißt Endozytose. ApoE im Zusammenspiel mit Sortilin hat einen ganz wesentlichen Einfluss auf unsere Hirngesundheit: Gelangen nicht genug mehrfach ungesättigte Fettsäuren in die grauen Zellen, verkümmern diese und sind anfällig für Entzündungsreaktionen.
Doch ApoE ist nicht gleich ApoE. Beim Menschen existiert es in drei Genvarianten: ApoE2, ApoE3 und ApoE4. Hinsichtlich ihrer Aufgabe, Lipide zu transportieren, unterscheiden sie sich nicht. Auch die Fähigkeit, an Sortilin zu binden, ist allen drei Varianten gleich. Allerdings haben Menschen, die eine E4-Form tragen, gegenüber denen mit der E3-Variante ein zwölfmal höheres Risiko, an Alzheimer zu erkranken. „Warum ApoE4 das Alzheimerrisiko so stark erhöht, ist eine der zentralen Fragen in der Alzheimerforschung“, sagt Professor Thomas Willnow, der am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) seit vielen Jahren die Entstehung neurodegenerativer Erkrankungen untersucht. Etwa 15 Prozent der Menschen bilden ApoE4. Willnow ist auch an der Charité – Universitätsmedizin Berlin und der Aarhus University affiliiert.
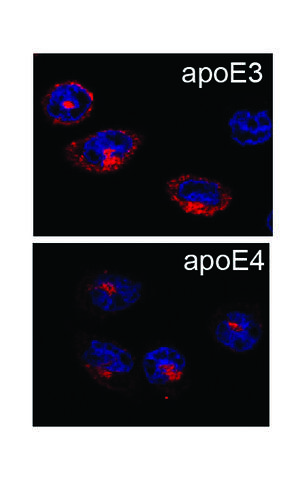
ApoE4 verhindert das Recycling von Sortilin
Bei Bindung von apoE3 kann der Rezeptor Sortilin (rot) an die Zelloberfläche gelangen. Die Bindung von apoE4 verklumpt ihn im Innern der Zelle. Er wird funktionslos.
Eine Studie von Willnows Arbeitsgruppe liefert nun eine mögliche Erklärung, warum ApoE4 so gefährlich für das Gehirn ist. Erstautor der Studie, die kürzlich in der Fachzeitschrift Alzheimer’s & Dementia publiziert wurde, ist Dr. Antonino Asaro vom MDC. Bei der E3-Variante läuft die Endozytose reibungslos ab: Sortilin bindet mit Fettsäuren-beladenes ApoE3. Nachdem es seine Fracht im Inneren der Nervenzellen abgeliefert hat, kehrt freies Sortilin zurück zur Zelloberfläche, um neues ApoE zu binden. Dies wiederholt sich viele Male pro Stunde, und die Nervenzellen werden ausreichend mit essenziellen Fettsäuren versorgt.
Der Vorgang gerät ins Stocken, wenn ApoE4 beteiligt ist. Bindet Sortilin ApoE4 und transportiert es ins Zellinnere, verklumpt der Rezeptor darin. Er kann nicht zur Zelloberfläche zurückkehren, die Endozytose kommt zum Erliegen. Bei manchen Menschen ist dies der Auftakt zur allmählichen Schädigung des Gehirns. Es werden immer weniger Fettsäuren aufgenommen, die grauen Zellen können sich nicht schützen und entzünden sich. Dadurch werden sie während des Alterungsprozesses anfälliger für den Zelltod – sie sterben ab. Das Risiko einer Alzheimerdemenz steigt damit rapide.
„Wir haben ein maßgeschneidertes Mausmodell genutzt, um den menschlichen Lipidstoffwechsel abzubilden“, erklärt Willnow. Dafür hat sein Team Mäuse mit verschiedenen ApoE-Varianten des Menschen gezüchtet, sowohl mit ApoE3 als auch mit ApoE4. Dann untersuchten die Forscher*innen die Lipidzusammensetzung der Maushirne per Massenspektrometrie, einem technischen Verfahren, mit dem Atome und Moleküle analysiert werden können. In den Hirnzellen der Mäuse mit ApoE3 lief ein gesunder Lipidstoffwechsel ab: Die Menge an ungesättigten Fettsäuren und Endocannabinoiden im Gehirn war ausreichend. Bei den E4-Mäusen hingegen kamen zu wenig Nährstoffe in den Hirnzellen an. Unter dem Mikroskop zeigte sich, dass die Membranbläschen, die normalerweise Sortilin aus dem Zellinneren zurück zur Zelloberfläche bringen, bei ApoE4 in der Nervenzelle feststeckten – ein Hinweis darauf, dass ApoE4 den Rezeptor verklumpt.
Neuer Ansatz für Alzheimer-Therapeutikum?
Einige Alzheimer-Forscher*innen gehen davon aus, dass die in Fischölkapseln enthaltenen ungesättigten Fettsäuren das Gehirn vor neurodegenerativen Prozessen schützen.
„Diese Erkenntnis liefert möglicherweise den Ansatz für eine neue Strategie in der Alzheimer-Therapie“, sagt Willnow. Menschen mit der E4-Variante könnten mit einem Mittel behandelt werden, das verhindert, dass das ApoE4 den Rezeptor verklumpt. In Nervenzellkulturen werden solche Wirkstoffe bereits erprobt.
In Kooperation mit Wissenschaftler*innen des Neuroforschungszentrums der Universität Aarhus in Dänemark wird die MDC-Gruppe um Willnow nun an einem solchen Therapeutikum arbeiten. Die Novo Nordisk Foundation stellt für diese Forschung sieben Millionen Euro zur Verfügung. „Wenn es gelingt, ein solches Medikament zu entwickeln, könnte ein Screening auf ApoE4 sinnvoll sein“, sagt der Zellbiologe. Dann könnten frühzeitig präventive Maßnahmen gegen den Abbau der grauen Zellen bei Menschen mit genetischem Risiko ergriffen werden. „Doch bis es so weit ist, möchte ich selbst lieber nicht wissen, welche ApoE-Variante ich habe.“
Text: Jana Ehrhardt-Joswig
Weiterführende Informationen
- MDC Pressemitteilung: Neue deutsch-dänische Forschungskooperation
Literatur
Antonino Asaro et al (2020): „Apolipoprotein E4 disrupts the neuroprotective action of sortilin in neuronal lipid metabolism and endocannabinoid signaling“, Alzheimer’s & Dementia, DOI:10.1002/alz.12121
Pressekontakte
Professor Thomas Willnow
Leiter der Arbeitsgruppe „Molekulare Herz-, Kreislaufforschung“
Max-Delbrück-Centrum für Molekulare Medizin
in der Helmholtz-Gemeinschaft (MDC)
willnow@mdc-berlin.de
Christina Anders
Redakteurin, Kommunikationsabteilung
Max-Delbrück-Centrum für Molekulare Medizin
in der Helmholtz-Gemeinschaft (MDC)
+49 (0)30 9406 2118
christina.anders@mdc-berlin.de oder presse@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.