Wie die Niere bei Wassermangel hochkonzentrierten Urin herstellt
Wird das Wasser knapp, stellen Menschen und andere höhere Organismen nur noch geringe Mengen Urin her. „Damit der Körper möglichst wenig Flüssigkeit verliert, wird in den Sammelrohren der Niere Wasser aus dem Urin rückresorbiert. Dies ist überlebenswichtig“, sagt Professor Kai Schmidt-Ott vom Max-Delbrück-Centrum für Molekulare Medizin (MDC) und von der Medizinischen Klinik für Nephrologie und internistische Intensivmedizin der Charité – Universitätsmedizin Berlin.
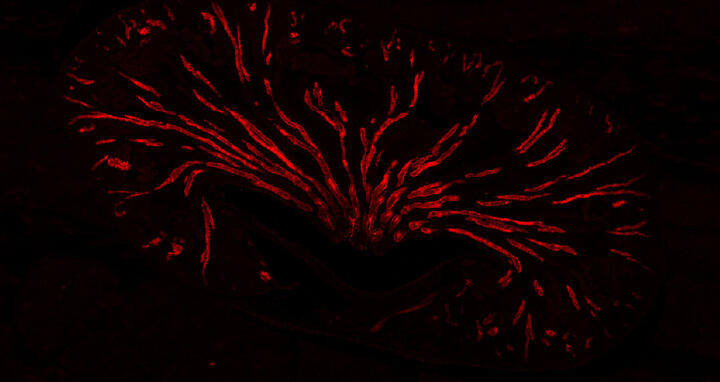
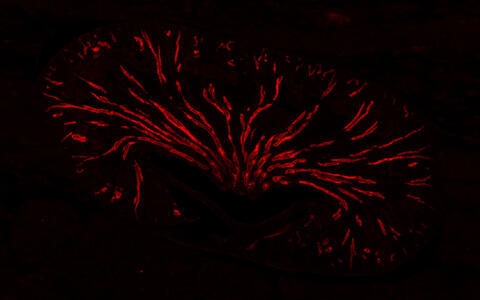
Die Niere einer Maus unter dem Mikroskop (Überblick). Das Sammelrohr ist mit einem Fluoreszenzfarbstoff rot eingefärbt.
Damit die Rückresorption gelingt, muss das Nierenmark, das die Sammelrohre umgibt, große Mengen Salze und Harnstoff anhäufen. Denn nur dann kann Wasser bei Bedarf dem osmotischen Gefälle folgen und von den Sammelrohren ins Nierenmark und anschließend zurück ins Blut gelangen.
Mit GRHL2 dichten sich die Zellen des Sammelrohrs ab
„Wir haben nun erstmals einen wichtigen molekularen Schalter identifiziert, über den die hohe Salzkonzentration im Nierenmark aufrechterhalten werden kann“, sagt der Erstautor der Studie, Dr. Christian Hinze vom MDC. Dabei handelt es sich um das Protein Grainyhead-like 2, kurz GRHL2 – ein Transkriptionsfaktor, der die Aktivität von Genen steuern kann.
Das Molekül wird in den Zellen des Sammelrohrs produziert und es bewirkt, dass die Zellen eine dichte Barriere zwischen dem Urin und dem Nierenmark ausbilden können. Gemeinsam mit Kollegen der Berliner Charité sowie Forschern aus Kiel, Norwegen und den USA haben die MDC-Wissenschaftler ihre Erkenntnisse jetzt im Fachblatt Journal of the American Society of Nephrology veröffentlicht.
Genveränderte Mäuse produzierten mehr Urin
Versuche mit Zellkulturen des Sammelrohrs zeigten, dass GRHL2 die Dichtigkeit der Verbindung zwischen den Zellen maßgeblich beeinflusst. „Normalerweise bilden Sammelrohrzellen eine dichte Barriere zwischen Urin und dem umgebenden Gewebe“, sagt Hinze. „Zellen, denen GRHL2 fehlt, werden durchlässig für bestimmte Stoffe.“ Weiterführende Untersuchungen bestätigten die Vermutung, dass die Zellen des Sammelrohrs ohne das Molekül GRHL2 undicht werden – und somit Salze und Harnstoff durch die Zell-Zell-Kontakte passieren lassen.
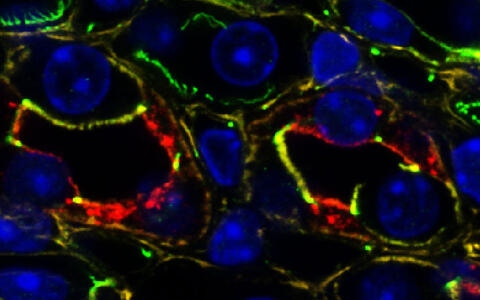
Die Niere einer Maus unter dem Mikroskop. Zwei Sammelrohre sind im Querschnitt sichtbar. die Proteine des Gewebes sind mit Fluoreszenzfarbstoffen gefärbt.
Im nächsten Schritt überprüften die Wissenschaftler die gewonnenen Erkenntnisse im Tiermodell. Dazu veränderten Schmidt-Ott und seine Kollegen die Gene von Mäusen so, dass GRHL2 nur in den Sammelrohren der Niere fehlte.
„Äußerlich waren die genetisch veränderten Tiere zunächst unauffällig“, sagt Schmidt-Ott. Auch ihre Nieren sahen ganz normal aus; lediglich unter dem Mikroskop konnte man erkennen, dass die Zellen des Sammelrohrs etwas kleiner waren als gewöhnlich. „Allerdings produzierten die genveränderten Mäuse mehr Urin als normale Artgenossen und gleichzeitig war dieser verdünnt“, erklärt Hinze. Zudem ließ sich feststellen, dass die Konzentration von Kochsalz im Nierenmark herabgesetzt war.
Bei Wassermangel versagten die Nieren der Tiere
Problematisch wurde die vermehrte Urinproduktion der Tiere, sobald sie wenig zu trinken bekamen. Ihre Kreatinin- und Harnstoff-Werte, zwei wichtige Laborparameter zur Beurteilung der Nierenfunktion, schossen dann in die Höhe. „Offensichtlich versagten die Nieren der Mäuse“, sagt Hinze.
„Auf diese Weise konnten wir erstmals zeigen, wie wichtig die Zellbarriere des Sammelrohrs für die hohen Konzentrationen gelöster Stoffe in der Niere ist – und damit für die Konzentrierung des Urins “, sagt der Leiter der Studie, Kai Schmidt-Ott. Die Forscher gehen davon aus, dass die gewonnenen Erkenntnisse auf den Menschen übertragbar sind, denn auch die menschliche Niere bildet das Protein GRHL2.
„Wir haben nun grundlegend neue Informationen, um beispielsweise den Diabetes insipidus, ein hochproblematisches Krankheitsbild beim Menschen, weiter zu erforschen“, sagt Schmidt-Ott. Bei dieser Krankheit scheiden die Nieren vermehrt Wasser aus; die Folgen sind starker Harndrang und großer Durst. Spannend ist für die Wissenschaftler am MDC nun zudem die Frage, ob sich GRHL2 auf irgendeine Art und Weise steuern lässt – um Patienten mit einem gestörten Wasserhaushalt eines Tages womöglich besser als bisher helfen zu können.
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.
Weiterführende Links
Christian Hinze et al (2018): „GRHL2 Is Required for Collecting Duct Epithelial Barrier Function and Renal Osmoregulation.“ J Am Soc Nephrol 29. (online 13.12.2017) doi:10.1681/ASN.2017030353