Einem Enzym ins Herz geschaut
Oft sind es nur kleine Veränderungen, die letztendlich Großes bewirken. Das gilt selbst für Proteine: Wird an einem Ende dieser riesigen Moleküle lediglich ein Wasserstoffatom gegen eine Acetylgruppe ausgetauscht, erhält das Protein durch diese bestimmte chemische Struktur ganz neue Eigenschaften. Es kann dann zum Beispiel mit anderen Proteinen interagieren, es verändert seine Lebenszeit oder ist plötzlich in der Lage, ganz neue Ziele in der Zelle aufzusuchen.
Ein wichtiger Regulationsmechanismus von Zellen
Die N-terminale Acetylierung ist eine sehr häufig vorkommende – und damit für die vielfältigen Funktionen in der Zelle äußerst wichtige – Modifizierung von Proteinen.
Die Acetylierung von Proteinen, wie der Austausch eines Wasserstoffatoms durch eine Acetylgruppe genannt wird, ist somit ein wichtiger Regulationsmechanismus von Zellen. In Gang gesetzt wird die Acetylierung unter anderem von einer Gruppe von Enzymen, den N-terminalen Acetyltransferasen, kurz NATs. Diese acetylieren stets das N-terminale Ende des Proteins, also dort, wo eine Aminosäure mit einer freien Aminogruppe sitzt.
In menschlichen Zellen gibt es eine Vielzahl verschiedener NATs; nur von wenigen war jedoch bislang auch die detaillierte Struktur bekannt. Den genauen Aufbau der Acetyltransferase NatC hat nun ein Team um Professor Oliver Daumke, Leiter der Arbeitsgruppe „Strukturbiologie Membran-assoziierter Prozesse“ am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), zusammen mit Forschenden der Charité – Universitätsmedizin Berlin, entschlüsselt. Die Ergebnisse der Arbeit sind im Fachblatt „Nature Communications“ publiziert.
Im Menschen sind die meisten Proteine acetyliert
Erstautor der Studie ist der Strukturbiologe Dr. Stephan Grunwald, ehemaliger Doktorand und jetzt PostDoc in Daumkes Team. „Die N-terminale Acetylierung ist eine sehr häufig vorkommende – und damit für die vielfältigen Funktionen in der Zelle äußerst wichtige – Modifizierung von Proteinen“, sagt Grunwald. „Im Menschen sind etwa 80 bis 90 Prozent aller Proteine auf diese Weise verändert.“
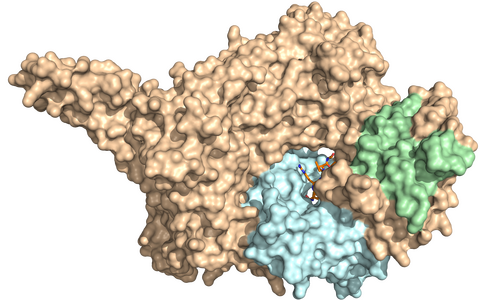
Röntgenkristallstruktur von NatC. Der dreiteilige Komplex besteht aus einer katalytischen Untereinheit (hellblau) und einer großen und kleinen Hilfsuntereinheit (in braun und grün). Eine herausragende Spitze von NatC wird für die Interaktion mit dem Ribosom benötigt.
Grunwald nutzte Bakterien der Art Escherichia coli, in die er die drei Gene für NatC eingeschleust hatte. „Diese Bakterien stellten für uns größere Mengen von NatC her, die wir anschließend gereinigt, kristallisiert und dann per Röntgenkristallographie näher untersucht haben“, berichtet Grunwald. Bekannt war bereits, dass NatC aus einer katalytischen und zwei Hilfs-Untereinheiten besteht. „Wie diese aber in dem NatC-Komplex angeordnet sind und welche Funktionen sie jeweils besitzen, mussten wir erst herausfinden“, sagt Grunwald.
Röntgenstrahlen helfen bei der Strukturaufklärung
Für die Röntgenkristallographie ist es erforderlich, das Enzym durch bestimmte chemische Zusätze zunächst kristallisieren zu lassen. „Man erhält dann etwa ein Zehntel Millimeter lange Kristalle, in denen jeweils viele Millionen der NatC-Komplexe ganz regelmäßig angeordnet sind“, sagt Grunwald. Die Kristalle werden bei -196 Grad Celsius schockgefroren und dann mit intensiven Röntgenstrahlen beschossen, welche an einem Teilchenbeschleuniger – wie dem „BESSYII“ in Berlin-Adlershof – erzeugt werden.
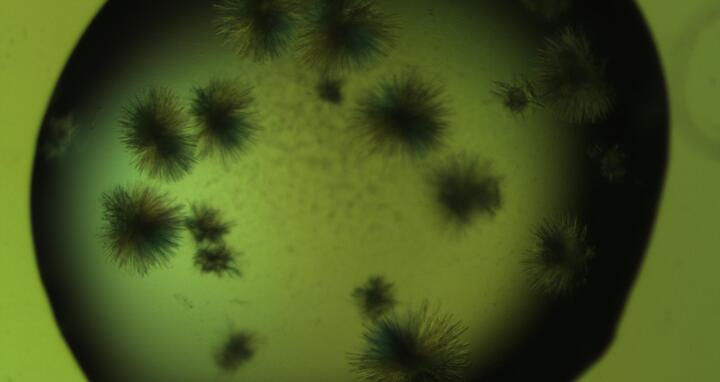
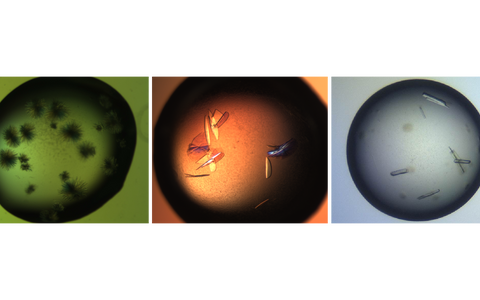
NatC-Kristalle unter dem Mikroskop. Kristall-Nadelhaufen (links) konnten bereits zu Beginn des Projektes erzeugt werden; diese sind für die Strukturaufklärung jedoch zu klein. Kristallplatten (mitte) und -stäbchen (rechts), welche zur Datensammlung genutzt werden konnten, erschienen erst nach langwieriger Optimierung.
„Anhand des Musters, nach dem die Strahlen gestreut werden, können wir Rückschlüsse auf die dreidimensionale Struktur des Proteins ziehen“, erläutert Daumke. Wie er und sein Team herausfanden, wird die katalytische Untereinheit von NatC, an der die Acetylierung von Proteinen vorgenommen wird, von einer kleinen und einer sehr großen Hilfseinheit umgeben. „Letztere dient als Gerüst für das gesamte Enzym“, sagt Daumke.
Links: Ein Zehntel Millimeter großer NatC-Kristall enthält Abermillionen Kopien des NatC-Moleküls und wird mit Hilfe einer kleinen Nylon-Schlaufe „gefischt“. Rechts: Bei Beschuss mit intensiver Röntgenstrahlung am BESSY II Teilchenbeschleuniger (Berlin-Adlershof) entsteht das charakteristische Kristall-Beugungsmuster, aus welchem Rückschlüsse über die dreidimensionale Struktur des Proteins getroffen werden können.
Das Enzym wartet am Ende der Produktionsstraße
Darüber hinaus konnten die Forscherinnen und Forscher der Acetyltransferase noch weitere Geheimnisse entlocken. „Es war bereits bekannt, dass sich NatC an die Ribosomen, die Proteinfabriken der Zelle, heftet“, berichtet Grunwald. „Mit Hilfe von Bindungsstudien konnten wir zeigen, dass eine positiv geladene Spitze von NatC für die Bindung an das Ribosom notwendig ist. Dort sitzt es quasi am Ende der Produktionsstraße und wartet darauf, dass ein neues, noch ungefaltetes Protein herausgefahren wird.“ Anhand der ersten vier Aminosäuren des neu hergestellten Proteins kann NatC erkennen, ob es dieses acetylieren soll oder nicht.
Das Herzstück von NatC entschlüsselt
Mit Hilfe der Struktur konnten die Forscherinnen und Forscher sogar herausfinden, wie das Herzstück von NatC, die katalytische Untereinheit, im Detail schlägt. „Im katalytischen Zentrum des Enzyms haben wir mehrfach einzelne Aminosäuren verändert“, berichtet Grunwald. Er und seine Kolleginnen und Kollegen wissen daher jetzt ganz genau, wie es im Herzen von NatC aussieht und nach welchem Mechanismus die Acetylierung dort erfolgt.
Das katalytische Zentrum von NatC blockieren
Wichtig werden könnte das eines Tages unter anderem in der Krebstherapie. „In bestimmten entarteten Zellen ist NatC oft überaktiv“, sagt Grunwald. „Es wäre also zumindest denkbar, Medikamente zu entwickeln, die das katalytische Zentrum des Enzyms blockieren – und so womöglich auch das Tumorwachstum aufhalten.“ Zunächst aber will der Strukturbiologe seine Erkenntnisse an die Zellbiologen weiterreichen: „Nachdem wir die genaue Struktur von NatC ermittelt haben“, sagt er, „können sie jetzt gezielt die genauen Funktionen von NatC im menschlichen Körper herausfinden.“
Text: Anke Brodmerkel
Weiterführende Informationen
Literatur
Grunwald, Stephan et al. (2020): “Divergent architecture of the heterotrimeric NatC complex explains N-terminal acetylation of cognate substrates”, Nature Communications, DOI: 10.1038/s41467-020-19321-8