An den Schaltstellen des Wasserrecyclings
Unser Körper besteht zum größten Teil aus Wasser. Täglich verlieren wir einen Teil davon durch Schweiß und Ausscheidungen und ergänzen den Verlust durch Essen und Trinken, doch das meiste Wasser wird sorgfältig recycelt. Eine Reihe von Erkrankungen sind durch eine unzureichende oder allzu starke Wasserrückresorption in der Niere gekennzeichnet. Daher sind detailierte Erkenntnisse, die zum Verstehen dieses Systems beitragen, von großem Interesse für Kliniker und Medikamentenentwickler. Jetzt ist es der Arbeitsgruppe um Enno Klussmann und Walter Rosenthal am MDC gelungen einen wichtigen Schritt in dem Signalsystem aufzuklären, das die Wasserrückresorption reguliert. Hierzu entwickelte die Gruppe in Zusammenarbeit mit der Screening Unit am Leibniz-Institut für Molekulare Pharmakologie (FMP) eine neue Methode zur Identifizierung von Komponenten dieses Systems. Die neue Studie, veröffentlicht am 30. April im Journal of the American Society of Nephrology, identifiziert Moleküle, die den Transport des Wasserkanalproteins Aquaporin-2 blockieren. Die Entdeckung liefert neue Einsichten in die Mechanismen der renalen Wasserrückresorption und die eingesetzte Methode legt den Grundstein für die Identifizierung weiterer Komponenten des Systems.
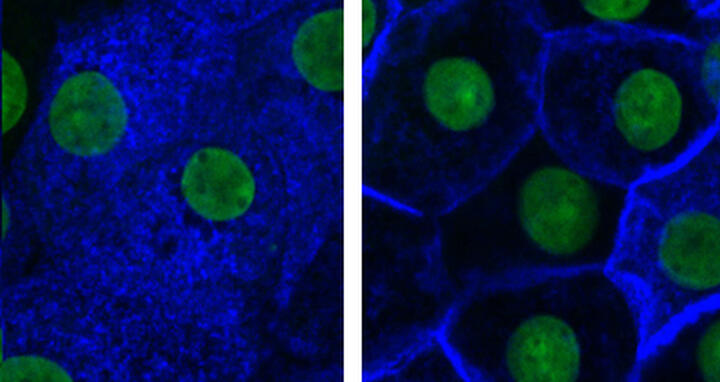
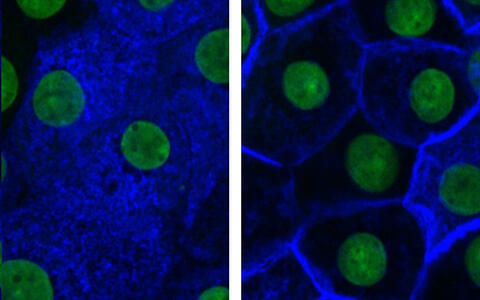
Renale Hauptzellen mit Aquaporin-2 (blau) im Zellinnern (links) und in der Plasmamembran (rechts). Die von der MDC-Arbeitsgruppe entdeckte Substanz (4-Acetyldiphyllin) verhindert die Lokalisierung von Aquaporin-2 in der Zellmembran. Zellkerne sind grün gefärbt.
Sammelrohre in der Niere resorbieren abhängig von den Bedürfnissen des Körpers, Aktivität und anderen Faktoren mehr oder weniger Wasser [aus dem Primärharn und regulieren damit dessen Konzentration]. Dabei spielt das Hormon Vasopressin eine Schlüsselrolle. Es stimuliert die sogenannten Hauptzellen [im Epithel der Sammelrohre] und sorgt dafür, dass mehr Wasser aufgenommen wird. Dies geschieht dadurch, dass durch die Hormonwirkung Wasserkanalproteine, sogenannte Aquaporine, vom Zellinneren an die Zelloberfläche wandern, wo sie Poren bilden, die spezifisch den Durchtritt von Wassermolekülen durch die Plasmamembran erlauben.
Wenn gesunde Sammelrohr-Epithelzellen Vasopressin registrieren, beginnen sie mit der Synthese des Signalmoleküls cAMP. Dadurch wird eine Kaskade von biochemischen Signalen ausgelöst, die schließlich die Aquaporin-2-Moleküle erreicht [die im Zellinneren in inaktiver Form vorhanden sind]. Im nächsten Schritt werden dann spezifische Aminosäuren der Aquaporin-2-Moleküle phosphoryliert oder dephosphoryliert [worauf die Wanderung der Kanalproteine an die Zelloberfläche einsetzt.]
"Bisher wurde davon ausgegangen, dass die Phosphorylierung der Aminosäure Serin-256 den Hauptauslöser der Proteinwanderung vom Zellinneren an die Plasmamembran darstellt. Doch auch das, was an anderen Phosphorylierungsstellen geschieht, könnte zu diesem Transport beitragen", erklärt Enno Klussmann.
An der von FMP und MDC gemeinsam betriebenen Screening Unit [einer Einrichtung zur Suche nach neuen Wirkstoffen] wurde eine neue Methode zur Identifizierung von Molekülen entwickelt, die den Transport von Aquaporin-2 hemmen. Dabei wurden Zellkulturen von [genetisch veränderten] renalen Hauptzellen der Maus eingesetzt, die menschliches Aquaporin-2 enthalten. Zunächst wurden die Zellen mit [getrennt voneinander] 17.700 unterschiedlichen kleinen Molekülen aus der "Bibliothek" der Screening Unit inkubiert, Dann wurden diese Zellen zusätzlich mit einer Substanz stimuliert, die die Produktion von cAMP auslöst und normalerweise den Transport von Aquaporin-2 an die Zelloberfläche bewirkt. „Anschließend verwendeten wir zur Markierung von Aquaporin-2 einen [mit einem Farbstoff gekoppelten] Antikörper und konnten so das Aquaporin unter dem Mikroskop sichtbar machen", so Enno Klussmann. "Bei jeder getesteten Substanz konnte man also beobachten, ob in ihrer Anwesenheit der Kanal in der Zelle 'feststeckte' oder zur Plasmamembran wanderte. Aber man stelle sich vor, das nacheinander mit 17.700 verschiedenen Zellkulturen zu machen bis man schließlich einen Inhibitor findet – das hätte Jahre gedauert."
Die Entwicklung eines automatisierten Alternativverfahrens war ein langwieriger Prozess. Jana Bogum und andere Teammitglieder nutzten ein automatisches Screening-Mikroskop und ein Computerprogramm, das automatisch Bilder der Zellkulturen aufnimmt und nach Fällen suchte wo Aquaporin-2 nicht wanderte. Sie fanden 17 potentielle Inhibitoren, von denen 14 in einer zweiten Versuchsserie mit ähnlichen Zellen von der Ratte getestet wurden. Am Ende blieben schließlich fünf Substanzen übrig.
"Wir schauten uns zwei dieser Substanzen näher an in der Hoffnung, mehr über die Mechanismen zu erfahren, die beim Transport des Kanalproteins eine Rolle spielen", so Klussmann. "Eine der beiden, 4-Acetyldiphyllin, kurz 4AD, war besonders interessant."
In den Zellkulturen blockierte diese Substanz den Transport von Aquaporin-2 zur Zelloberfläche und Aquaporin-2 landete in der Intrazellulärstruktur Golgiapparat. Überraschenderweise verhinderte 4AD die Phosphorylierung der kritischen Aminosäure Serin-256 im Aquaporin-2. Dagegen verhinderte es nicht die Markierung einer zweiten und auch nicht die Dephosphorylierung einer dritten Aminosäure, die bislang mit dem Molekültransport in Verbindung gebracht worden waren.
"Das unterstreicht, dass eine einzige Stelle – Serin-256 – entscheidend ist für den Transport", so Klussmann. "Bisher war nicht klar, dass diese Markierung am Serin 256 unabhängig von den Ereignissen an den anderen Stellen ist."
Aquaporin-2 wird für den Transport an die Zelloberfläche in kleine Membrankompartimente, "Vesikel", verpackt. Normalerweise ist es im Inneren dieser Vesikel sehr sauer. 4AD blockiert das Enzym, das sonst diese Kompartimente ansäuert, wodurch sie möglicherweise als Transportmittel unbrauchbar werden. Auf der mechanistischen Ebene zeigt die Arbeit erstmals, dass die Aktivität des Enzyms, das die Vesikel ansäuert, die Phosphorylierung von Aquaporin-2 kontrolliert und damit auch seine Lokalisierung.
Enno Klussmann erklärt: "Diese Studie stellt einen grundsätzlichen Machbarkeitsnachweis dar, einen proof of principle. Erstens konnten wir mit unserer automatisierten Screening-Methode erfolgreich neue Verbindungen identifizieren, die für die Behandlung von Störungen der Wasserrückresorption interessant sein könnten. Hier gibt es Zusammenhänge mit Erkrankungen wie chronischer Herzinsuffizienz. Zweitens gewinnen wir mit diesen Verbindungen neue Einsichten in die komplexe Regulation von Wasserkanälen in renalen Hauptzellen."
- Russ Hodge
(Übersetzung: Dietmar Zimmer)
Highlight Reference:
Bogum J, Faust D, Zühlke K, Eichhorst J, Moutty MC, Furkert J, Eldahshan A, Neuenschwander M, von Kries JP, Wiesner B, Trimpert C, Deen PM, Valenti G, Rosenthal W, Klussmann E. Small-molecule screening identifies modulators of aquaporin-2 trafficking. J Am Soc Nephrol. 2013 Apr;24(5):744-58.
Full text of the original paper