Aktuelle DFG-Förderung für MDC-Forscher*innen
Der Startschuss für neue Sonderforschungsbereiche der Deutschen Forschungsgemeinschaft (DFG) ist gefallen. Daneben finanziert die DFG im Rahmen ihrer Fokus-Förderung COVID-19 erstmals 33 Forschungsvorhaben zur Infektion mit SARS-CoV-2. Damit Forscher*innen besonders drängende Fragen im Zusammenhang mit der Corona-Pandemie schnell bearbeiten können, zeichnet sich dieses neue Förderinstrument durch ein vereinfachtes Verfahren aus. An zwei neuen SFBs und einem COVID-19-Forschungsprojekt sind Wissenschaftler*innen des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft beteiligt.
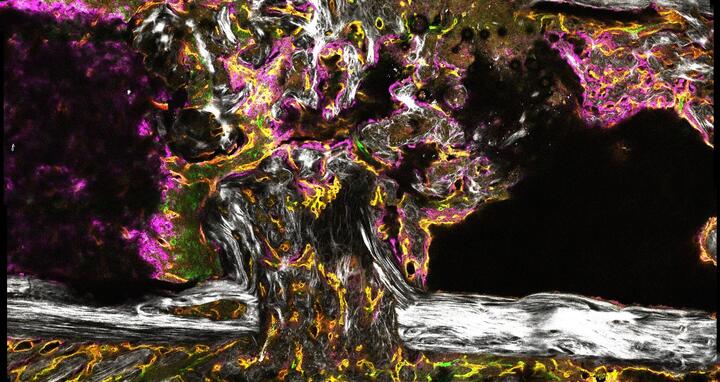
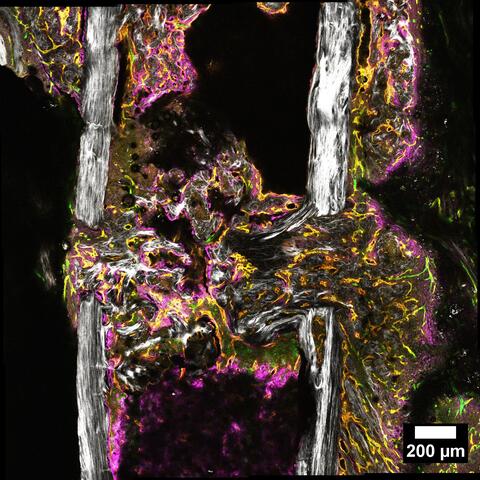
Gesunde Blutgefäße – vitaler Knochen
Gefäßneubildung im heilenden Knochen einer Maus, 14 Tage nach der Osteotomie
Im SFB 1444 „Gesteuerte zelluläre Selbstorganisation zur Verbesserung der Knochenregeneration – Directed Cellular Self-Organisation for Advancing Bone Regeneration“ untersuchen die Forscher*innen die grundlegenden Mechanismen der Knochenregeneration. Knochengewebe ist eines der wenigen, das narbenlos heilt. Damit ist Knochen ein ideales Modellsystem, um generelle Prinzipien körpereigener Heilung und zellulärer Selbstorganisation zu verstehen. Bei jungen und gesunden Menschen funktionieren diese Prozesse grundsätzlich gut. Mit zunehmendem Alter, Mangel an Bewegung, chronischen Entzündungen und Stoffwechselstörungen verändern sie sich jedoch. Deshalb treten bei Älteren muskuloskelettale Erkrankungen häufiger auf. Ein tiefergehendes Verständnis, wie sich die körpereigenen Heilungsprozesse aufgrund von Alterung, Stoffwechselerkrankungen oder veränderter Immunantwort ändern – Wissenschaftler*innen sprechen vom „Immunoaging“ – fehlt weitestgehend. Ein solches Verständnis ist aber Voraussetzung für eine individuelle Behandlung dieser Patient*innen. Bislang werden sie grundsätzlich alle ähnlich behandelt, ungeachtet ihres unterschiedlichen Heilungspotenzials.
Der SFB soll zu diesem Verständnis beitragen. Die DFG fördert das Verbundprojekt zunächst für vier Jahre mit mehr als 12 Millionen Euro. Es wird von der Charité – Universitätsmedizin Berlin getragen. Neben Wissenschaftler*innen des Berlin Institute of Health (BIH), der Freien Universität Berlin, des Zuse-Instituts Berlin (ZIB), des Max-Planck-Instituts für Kolloid- und Grenzflächenforschung (MPIKG) sowie des Deutschen Instituts für Ernährungsforschung (DIfE) ist die Gruppe „Integrative vaskuläre Biologie“ um Professor Holger Gerhardt am MDC beteiligt. „Wir beschäftigen uns mit den Gefäßnetzwerken des Körpers“, fasst Gerhardt zusammen. Wie sich Gefäße im heilenden Knochen neu bilden, ist bislang wenig untersucht. Im SFB gehen die MDC-Mitarbeiter*innen der Frage nach, über welche Signalwege die Blutgefäßzellen im Knochen seine Heilung beeinflussen. Sie knüpfen dabei an Vorarbeiten der DFG-Forschungsgruppe 2165 an: „Regeneration im Alter: Die Knochenheilung als Modelsystem zur Charakterisierung der Regeneration unter erschwerten Bedingungen“.
Schützende Schleimschicht im Körperinneren
Das Besondere an diesem Konsortium ist, dass es sehr grundlegendes physikalisches und biologisches Fachwissen kombiniert, um ein vollständiges Verständnis der Mechanismen zu erlangen, die die Bildung von Hydrogelen beeinflussen.
Am SFB 1449 „Dynamische Hydrogele an Biogrenzflächen“ sind ebenfalls Forscher*innen des MDC beteiligt. Hydrogele haben eine wichtige Barrierefunktion: Sie bedecken die Schleimhäute auf den inneren Körperoberflächen, etwa in den Atemwegen oder im Darm, und schützen sie so vor Viren und Bakterien. Hydrogele bestehen aus wasserquellbaren Polymeren, die einen hohen Anteil an Wasser binden können. Bei Krankheiten wie Mukoviszidose, chronisch-obstruktiver Lungenerkrankung oder einigen entzündlichen Darmerkrankungen sind die Schleimhäute stark dehydriert. Im SFB wollen die Wissenschaftler*innen die wichtigsten physikalisch-chemischen Faktoren der Hydrogele bestimmen und auf molekularer Ebene untersuchen, wie sie sich verändern und Krankheiten entstehen. Damit wollen sie die Voraussetzungen für die Entwicklung neuer Therapien bei Lungen- und Magen-Darm-Erkrankungen schaffen.
„Es könnten zielgerichtete Medikamente entwickelt werden, die die Schutzfunktion der Schleimhaut, die durch Krankheit zerstört wurde, wiederherstellen“, wagt Sofia Forslund einen Blick in die Zukunft. Sie leitet am MDC eine Forschungsgruppe, die sich mit „Wirt-Mikrobiom-Faktoren in Herz-Kreislauferkrankungen“ beschäftigt. Im SFB geht sie der Frage nach, wie das Mikrobiom die Zusammensetzung der Hydrogele beeinflusst, die Schleimbarriere stärken oder zerstören kann. Neben Forslund engagiert sich Dr. Philipp Mertins für das SFB-Projekt. Er leitet die Proteomics-Technologieplattform am MDC. Mit seinem Team will er die Technologie vorantreiben, um die Proteine und Glykoproteine im Hydrogel besser charakterisieren zu können. Er arbeitet dafür mit der Gruppe um Kevin Pagel zusammen, Professor für organische Chemie an der Freien Universität.
„Das Besondere an diesem Konsortium ist, dass es sehr grundlegendes physikalisches und biologisches Fachwissen kombiniert“, sagt Forslund, „um ein vollständiges Verständnis der Mechanismen zu erlangen, die die Bildung von Hydrogelen beeinflussen.“ Der SFB hat eine Laufzeit von vier Jahren. Die Freie Universität Berlin trägt den SFB, Sprecher ist Professor Rainer Haag.
Die Expansionsstrategie des Coronavirus aufdecken
Coronaviren haben vielfältige Mittel und Wege, das Immunsystem zu verwirren (...) Ein tieferes Verständnis dieser Mechanismen hilft uns zu verstehen, warum genau SARS-CoV-2 so ansteckend ist.
Die COVID-19-Förderprojekte der DFG werden für ein Jahr mit jeweils 3,6 Millionen Euro finanziert. Gemeinsam mit Michael Sattler und Grzegorz Popowicz vom Helmholtz Zentrum München – Deutsches Forschungszentrum für Gesundheit und Umwelt und der Technischen Universität München (TUM) arbeitet Professor Dr. Markus Landthaler mit seiner AG „RNA Biologie und Posttranscriptionale Regulation“ an der „Biochemischen und strukturellen Charakterisierung des SARS-CoV-2 non-structural protein 16 (Nsp16), eine cap ribose 2’O-methyltransferase“.
Das SARS-CoV-2-Virus hat in seinem Erbgut Bauanleitungen für nur ungefähr zwei Dutzend Proteine – im Menschen sind es über 20000, die zudem noch in sehr vielen Varianten hergestellt werden. Einige von diesen wenigen Proteinen bilden das Gerüst für die Viruspartikel. Andere, und dazu gehört Nsp16, sorgen dafür, dass sich das Virus in menschlichen Zellen schnell vermehren und vor dem Immunsystem verstecken kann. Wissenschaftler*innen vermuten, dass Nsp16 das Erbgut des Virus so verändert, dass es in der Zelle nicht mehr als „viral“ erkannt wird. Es kann also beispielsweise dazu beitragen, dass sich das Virus ausbreiten kann, bevor die Menschen Symptome haben. „Coronaviren haben vielfältige Mittel und Wege, das Immunsystem zu verwirren, um sich möglichst schnell ausbreiten zu können“, sagt Markus Landthaler. „Ein tieferes Verständnis dieser Mechanismen hilft uns zu verstehen, warum genau SARS-CoV-2 so ansteckend ist.“
Text: Jana Ehrhardt-Joswig