Die Selbstheilung besser verstehen
Embryonale Zellen können sich in viele verschiedene Zelltypen verwandeln und so die unterschiedlichsten Organe hervorbringen. Adulten Zellen hingegen geht diese Fähigkeit nach und nach verloren: Einmal ausgereift, ist ihr weiteres Schicksal weitgehend festgelegt. Das ist der Grund, warum die Selbstheilungskräfte des Menschen zumindest begrenzt sind.
Bei vielen Tieren ist das anders. „Wichtige Organe von Zebrafischen zum Beispiel, etwa das Herz, das Gehirn und die Bauchspeicheldrüse, sind in der Lage, selbst nach einer schweren Verletzung zu regenerieren und ihre Funktionen wieder auszuüben“, erläutert Dr. Jan Philipp Junker, der Leiter der Arbeitsgruppe „Quantitative Entwicklungsbiologie“ am Berlin Institute for Medical Systems Biology (BIMSB), das zum Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) gehört. „Dazu nutzen die Organe ganz unterschiedliche Mechanismen“, sagt Junker.
Die Tricks der Zebrafische durchschauen
Der Systembiologe will herausfinden, wie den Zebrafischen die Regeneration gelingt – um von ihnen zu lernen und eines Tages womöglich bessere Therapien für Menschen zu entwickeln, die beispielsweise einen Herzinfarkt oder einen Schlaganfall erlitten haben oder an Diabetes leiden. Für sein aktuelles Forschungsprojekt, das er gemeinsam mit dem Entwicklungsbiologen Professor Nikolay Ninov vom Zentrum für Regenerative Therapien Dresden (CRTD) der Technischen Universität Dresden geplant hat, haben die beiden Forscher jetzt einen „DFG Sequencing Grant“ erhalten.
Mit dem Fördergeld will die DFG wichtige Projekte unterstützen, bei denen das „Next Generation Sequencing“ (NGS) zum Einsatz kommt. Dabei handelt es sich um moderne Sequenzierungstechniken, die in der Regel äußerst kostspielig sind. „Ich bin sehr glücklich darüber, dass wir unser ehrgeiziges Projekt jetzt in den kommenden drei Jahren mithilfe des Grants realisieren können“, sagt Junker. Die DFG wird ihm und Ninov nicht nur eine Postdoc- und eine Doktorandenstelle sowie Verbrauchsmaterialien finanzieren, sondern den beiden Forschern darüber hinaus ein Budget von rund 380.000 Euro allein für die geplanten Sequenzierungen zur Verfügung stellen.
Den Genen bei der Arbeit zugucken
Junker und Ninov wollen gemeinsam mit ihren Teams die Inselzellen der Bauchspeicheldrüse von Zebrafischen näher erforschen. Eine Gruppe dieser Zellen, die Beta-Zellen, stellt das blutzuckersenkende Hormon Insulin her. Gehen die Beta-Zellen allerdings durch eine Verletzung zugrunde, beginnen andere Inselzellen, die Alpha- und die Delta-Zellen, sich zu verwandeln und ebenfalls Insulin herzustellen. Bei Zebrafischen ist die Regulierung des Blutzuckers somit stets sichergestellt. Menschliche Inselzellen hingegen haben diese Fähigkeit nicht. Menschen, deren Beta-Zellen vom Immunsystem zerstört werden, erkranken am Typ-1-Diabetes.
„Wir möchten ergründen, auf welche Weise Entscheidungen über das Schicksal einer Zelle während der Embryonalentwicklung und der Regeneration getroffen werden – und ob sich die molekularen Vorgänge bei beiden Prozessen ähneln“, sagt Junker. „Dazu werden wir mit einer neuen Methode nicht nur messen, welche Gene gerade in den einzelnen Zellen aktiv sind, sondern wir werden auch bestimmen, welche Gene vor einigen Stunden exprimiert wurden.“ Dadurch lasse sich genauer beobachten, wie sich die Inselzellen von einem Zelltyp in einen anderen verwandeln, erläutert der Wissenschaftler.
Blockaden einfach aus dem Weg räumen
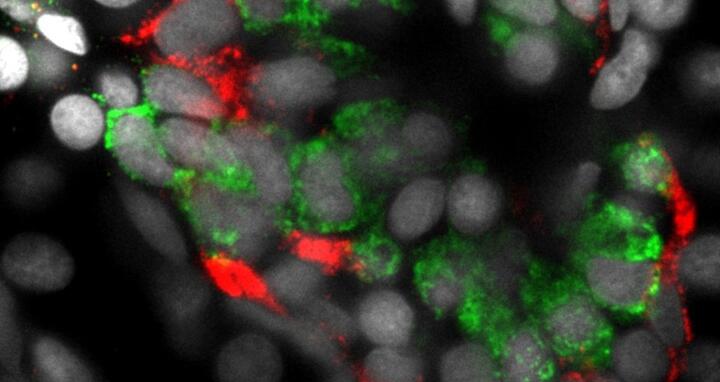
Dieses Bild zeigt Inselzellen in der Bauchspeicheldrüse eines Zebrafischs. Die insulinproduzierenden Beta-Zellen sind grün, die Glucagon-produzierenden Alpha-Zellen sind rot zu sehen.
Um die Mechanismen zu verstehen, mit denen das Ein- und Ausschalten der Gene gesteuert wird, wollen die Forscher zudem untersuchen, welche Segmente des Genoms für das Ablesen der Gene jeweils zugänglich und welche durch Proteine versperrt sind. „Man kann sich das Ganze vielleicht vorstellen wie bei einer Straßensperre“, sagt Junker: „Wenn wir die Barrieren entdecken, die einer Zelle bei ihrer Verwandlung im Weg stehen, können wir sie vermutlich auch aus dem Weg räumen – und so die an der Verwandlung beteiligten Gene nach unseren Wünschen gezielt ein- und ausschalten.“
Zu guter Letzt planen die beiden Teams, Vergleiche zu menschlichen Inselzellen zu ziehen. „Vielleicht sind die molekularen Barrieren ja ganz ähnlich wie bei den Zebrafischen“, spekuliert Junker. Die Vision zumindest ist da: Mithilfe geeigneter Techniken reißt man die Straßensperren, die den Alpha- oder Delta-Zellen bei ihrer Verwandlung in Insulin produzierende Zellen den Weg versperren, eines Tages einfach ein. Dann wäre eine Heilung des Typ-1-Diabetes möglich.
Text: Anke Brodmerkel
Weiterführende Informationen