Neuer Differenzierungsschalter im Darm identifiziert
„Der Darm ist ein fantastisches Organ, um das Zusammenspiel verschiedener Signalwege zu erforschen“, sagt Dr. Julian Heuberger über das größte Organ des Menschen. Das Besondere der Röhre von bis zu acht Metern Länge ist die Oberfläche: Sie misst 400 bis 500 Quadratmeter. Diese große Oberfläche wird durch mikroskopisch kleine, fingerähnlichen Fortsätze der Schleimhautzellen, dem sogenannten Bürstensaum (Mikrovilli), Einstülpungen der Schleimhaut in das darunter liegende Bindegewebe, den sogenannten Lieberkühnschen Krypten, sowie, zusätzlich im Dünndarm, durch Ausstülpungen der Schleimhaut in das Lumen, den sogenannten Darmzotten (Villi) und Faltenbildung (Kerckring-Falten) erreicht. Bemerkenswert ist auch die extrem hohe Regenerationsrate des Darmepithels. Alle vier bis fünf Tage erneuert es sich komplett. Hierbei werden aus den Stammzellen in den Krypten alle Epithelzelltypen durch Differenzierungsprozesse gebildet. Diese differenzierten Epithelzellen beinhalten neben den Zellen, die die Nährstoffe aufnehmen (absorptiven Enterozyten), Zellen, die Stoffe abgeben (sekretorischen Zellen), wie die Goblet- (Becherzellen), Tuft-, Paneth- und enteroendokrinen Zellen.
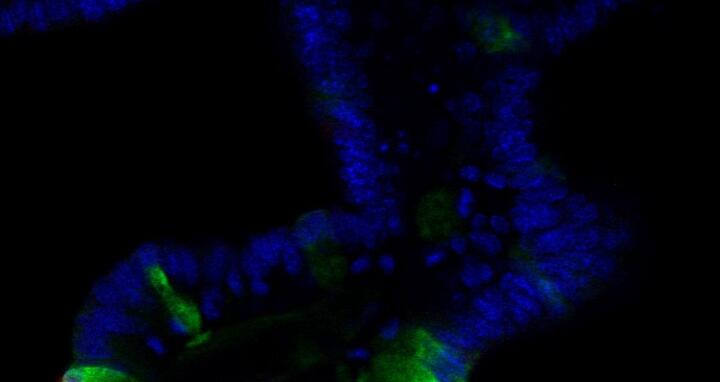
Wie gelingt es nun, schnell, organisiert und kontrolliert aus der Stammzellpopulation die verschiedenen Epithelzelltypen zu bilden? „In der Darmkrypte führt die Aktivierung verschiedener Signalwege zu unterschiedlicher Zelldifferenzierung oder zum Erhalt der Stammzellen. Die einzelnen Signalwege sind mittlerweile relativ gut erforscht; bestimmte Puzzleteile fehlen aber noch“, erklärt Heuberger. Eines hat er Anfang 2014 in einer Arbeit zusammen mit Prof. Walter Birchmeier geliefert. Das Team um die beiden Wissenschaftler zeigte erstmals, dass ein Signalweg, der über die Aktivierung der Tyrosinphosphatase Shp2 (Src homology 2 domain-containing protein tyrosine phosphatase 2) und dem in Folge vermittelten MAPK-(Mitogen-aktivierte Proteinkinase)-Signalweg mit entscheidet, ob aus einer Vorläuferzelle eine Goblet- oder Panethzelle wird. Für die Studie nutzten sie neben Mausmodellen auch in vitro Organoid-Systeme, die „bei bestimmten Fragestellungen eine exzellente Ergänzung zu klassischen Tiermodellen darstellen“, so Heuberger.
Das Shp2-Mausmodell und sein Phänotyp
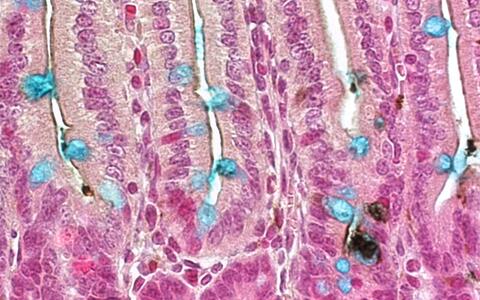
Vorangegangene Studien anderer Forschungsgruppen brachten den MDC-Wissenschaftlern die nötigen Hinweise, dass die Tyrosinphosphatase Shp2 ein Schalter in der Differenzierung von Darmzellen sein könnte. Um die Funktionen von Shp2 im Darm zu untersuchen, kreierten die Wissenschaftler mittels konditioneller Mutagenese einen speziellen Mausstamm, der kein Shp2 im Darmepithel bilden kann und somit Shp2-defizient ist. „Der Phänotyp dieser Mäuse war eindeutig“, erklärt Heuberger. „Die Shp-Mutanten zeigten drastisch reduzierte Gobletzellzahlen im Dünn- und Dickdarm und eine massive Erhöhung der Panethzellanzahl.“ Das führte mit zunehmendem Alter der Tiere zu Kolitis und Wachstumsverzögerung.
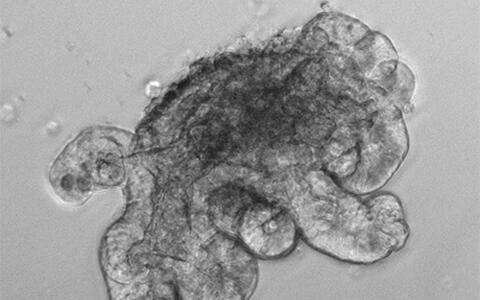
Die „Minidärme“ und ihr Beitrag zum Projekt
„Einen potentiell direkten Zusammenhang zwischen Shp2 Signalgebung und Panethzelldifferenzierung konnten wir wunderbar mittels unseres in vitro-Organoid-Systems testen“, berichtet Heuberger. „Unsere Darmorganoide sind einfach ausgedrückt „Minidärme“, allerdings ohne Bindegebe und Immunzellen. Es sind rein epitheliale Systeme, die wir aus isolierten Darmkrypten in der Zellkultur wachsen lassen.“ Aufgrund dieses rein epithelialen Charakters sind die Organoide zwar ein recht künstliches System, sie vereinfachen aber auf der anderen Seite die Erforschung intrinsischer biochemischer Prozesse des Epithels. Die Entfernung von Shp2 aus den Organoidkulturen führte zu einer erhöhten Anzahl von Panethzellen. „Dies war der direkte Beweis, dass die größeren Panethzellzahlen, die wir zuvor in den Mäusen identifiziert hatten, kein sekundärer Effekt war, etwa in Folge der Kolitis, sondern ein primärer Effekt.“
Frühere Studien hatten die Bedeutung des sogenannten kanonischen Wnt-Signaltransduktionswegs, welcher über das Molekül β-Catenin vermittelt wird, für die Panethzelldifferenzierung gezeigt. Eine von Heuberger und Team durchgeführte genomweite Expressionsanalyse der Shp2-defizienten Mausdärme konnte dies schließlich bestätigen und klärte auf, dass tatsächlich der Wnt/β-Catenin-Signalweg in diesen Tieren verstärkt aktiviert ist. Neben diversen Wnt-Liganden und -Zielgenen brachte diese Analyse auch zum Vorschein, dass das Stammzell-typische Lgr5-Gen (Leucin-reichen Abschnitt enthaltender G-Protein-gekoppelter Rezeptor 5) in den Shp2-defizienten Mäusen verstärkt gebildet wird. „Weiterführende Analysen bestätigten dies und zeigen, dass auch weitere Stammzellgene in den Shp2-Mutanten hochreguliert sind. Abschließend war klar, dass diese Mäuse nicht nur eine gesteigerte Panethzelldifferenzierung aufwiesen, sondern auch eine Erweiterung der Stammzellnische.“
Aufklärung des Signalmechanismus
Welchen Signalweg reguliert Shp2 in den beobachteten Prozessen, und wie wird die Aktivität der Wnt-Signalgebung beeinflusst? Das waren die Hauptfragen der Forscher zu diesem Zeitpunkt. „Ein heißer Kandidat, der in vielen Zelltypen durch Shp2 reguliert wird, ist der MAPK-Signalweg über die Kinase Mek1 (Mitogen-aktivierte Proteinkinasekinase, MAP2K1), die in Folge zwei weitere Kinasen, nämlich Erk1 und 2 (Mitogen-aktivierte Proteinkinase 1 & 3, MAPK3 & MAPK1), aktiviert. Das konnten wir nun auch für den Darm zeigen.“
Die Shp2-defizienten Mäuse wiesen drastisch reduzierte Level an aktiviertem Erk1 & 2 auf“, erläutert Heuberger. Weiterführende Experimente, die unter anderem auch die Erstellung eines Shp2-defizienten und Mek1-aktivierten doppelmutiertem Mausstamms beinhaltete, konnten diese Theorie untermauern. Diese Doppelmutanten, die in Kooperation mit Klaus Rajewsky erzeugt wurden, wiesen Gobletzellzahlen auf dem Niveau der Kontrolltiere sowie eine drastisch reduzierte Panethzellanzahl auf. Die zusätzlich eingeführte aktivierte Mek1-Kinase hatte also den Shp2-Gobletzellphänotyp rückgängig gemacht und die Panethzelldifferenzierung komplett verhindert. Zusätzlich zeigten diese Tiere eine Verkleinerung der Stammzellnische.
Als letzten Teil ihrer Analysen klärten die Wissenschaftler auf, dass die Mek1-basierte Regulierung der Wnt-Aktivität in der Differenzierung von Paneth- bzw. Gobletzelle posttranslational über eine Veränderung der Stabilität einer bestimmten Tcf-4-Form geschieht. Im Fokus standen zwei Subtypen mit unterschiedlichem Genaktivierungspotential, wobei die Shp2/Mek1-Aktivität das relative Verhältnis zwischen ihnen veränderte. Die Wissenschaftler konnten zeigen, dass die Shp2/Mek1-Aktivität die weniger genaktivierende Tcf4-Form über Beeinflussung der Proteindegradation im Proteasom stabilisiert. Heuberger erklärt zusammenfassend: „In dieser Studie haben wir gezeigt, dass das Zusammenspiel von Wnt- und Shp-MAPK-Signalweg in einer Vorläuferzellpopulation in der Darmkrypte die Spezialisierung bzw. Differenzierung in Goblet- oder Panethzelle reguliert. Überwiegt in der weiteren Differenzierung die Wnt-Signalgebung, wird in Richtung Panethzelle umgeschaltet; überwiegt die Shp2-MAPK-Signalkaskade findet verstärkte Gobletzelldifferenzierung statt.“
Weiterführende Nutzung der Organoide
„In meiner aktuellen Forschung, nutze ich das Organoid-System, um Effekte von Onkogenen und potentiell Tumor-unterstützenden Genen zu analysieren. Es liefert mir erste Hinweise, ob ein bestimmtes Molekül eine Rolle bei der Zellteilung und/oder Differenzierung und weiterführend auch bei der Krebsentstehung spielt. So kann man wunderbar die potentielle Relevanz eines neuen Tiermodells vorab testen“, berichtet Heuberger. Diese so veränderten Organoide bieten ihm das perfekte Werkzeug, um zu erforschen, wie Tumorzellen bestimmte Gen-Netzwerke aktivieren.
Beitragsbild: Julian Heuberger in seinem Labor. Foto: Susann Förster, MDC