Die Achillesferse der Tumorstammzellen
Die Therapiechancen sind sehr gering – auch weil selbst nach erfolgreicher Chemotherapie der Krebs wiederkommt.
Seitdem in Deutschland die Darmspiegelung zur Krebsfrüherkennung eingeführt wurde, sank die Zahl der jährlichen Krebsdiagnosen im fortgeschrittenen Stadium. Denn Krebsvorstufen können nun erkannt und im Rahmen der Untersuchung gleich entfernt werden. Die Sterblichkeit an Dickdarmkrebs ging dadurch zurück – bei Frauen um 26, bei Männern um 21 Prozent. Darmkrebs liegt dennoch auf Platz 4 der häufigsten Krebstodesursachen der westlichen Welt. Gleich hinter Lungen-, Prostata- und Brustkrebs. Das liegt daran, dass die langsam wachsenden Tumore sich erst im Spätstadium bemerkbar machen und deshalb häufig noch zu spät diagnostiziert werden. Die Überlebensrate bei fortgeschrittenem Darmkrebs liegt bei nur fünf Prozent.
„Die Therapiechancen sind sehr gering – auch weil selbst nach erfolgreicher Chemotherapie der Krebs wiederkommt“, sagt Johanna Grinat, Erstautorin der Studie und Doktorandin aus der Arbeitsgruppe „Signalvermittlung in Entwicklung und Krebsentstehung“. „Dann ist er häufig aggressiver als der ursprüngliche Tumor, wofür die Tumorstammzellen verantwortlich gemacht werden. Und diese haben wir uns genauer angesehen.“
Molekularer Schalter in Tumorstammzellen gefunden
Die Forschenden um Professor Walter Birchmeier haben mit Mll1 ein Protein identifiziert, das in der Maus und in menschlichen Darmkrebszellen Stammzellgene reguliert. In Mäusen haben sie genetisch die Bildung von Darmtumoren ausgelöst. Fehlt den Mäusen jedoch das Gen für Mll1, lassen sich keine Tumore induzieren. Und das scheint auch beim Menschen so zu sein: Humane Darmkrebszellkulturen, die das Team mit Tumorstammzellen angereichert hat, verloren einige Stammzelleigenschaften und verhielten sich weniger aggressiv, wenn Mll1 blockiert wurde. Zusammen mit Professor Eduard Batlle und Bioinformatikern am IRB in Barcelona zeigte die MDC-Gruppe anhand klinischer Daten, dass Darmkrebspatient*innen, deren Tumore eine große Menge des Proteins aufweisen eine schlechtere Prognose haben, als Patient*innen mit Tumoren und wenig Mll1.
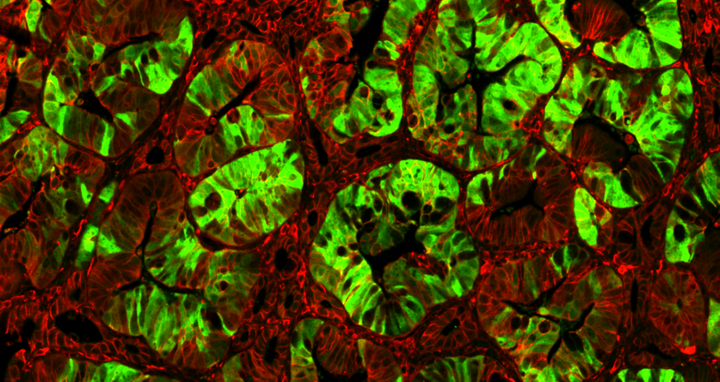
Expandierende Krebsstammzellen (grün) in einem Darmtumor mit onkogen aktiviertem Wnt/beta-Catenin Signalweg (rot).
Mll1 ist ein Enzym, das an der DNA sitzt und die Expression bestimmter Gene kontrolliert, epigenetisch, wie die Forschenden sagen. „Dies tut es insbesondere in den Tumor-Stammzellen, in denen der Wnt-Signalweg stark aktiviert ist. Was bedeutet, dass wir durch seine Deaktivierung spezifisch Tumorstammzellen behandeln können“, erklärt Grinat.
Mit Mll1 haben wir einen molekularen Schalter gefunden, der insbesondere die Selbsterneuerung und Teilung von Tumorstammzellen der Darmkarzinome kontrolliert.
Der Wnt-Signalweg reguliert die Selbsterneuerung und Zellteilung von Stammzellen. Treten Mutationen auf, die zu einer aktiveren Wnt-Signalkaskade führen, werden die betroffenen Stammzellen widerstandsfähiger als gesunde Stammzellen. Sie vermehren sich unkontrolliert und bilden Tumore. Eine Chemotherapie bremst zwar ihre Zellteilung, kann aber auch den Selektionsdruck auf Tumorstammzellen erhöhen: „Sie werden therapieresistent und bilden erneut Tumore, die nun aufgrund der Mutation stärker wachsen und deshalb so aggressiv sind“, sagt Dr. Julian Heuberger. Die Regulationsmechanismen speziell von Tumorstammzellen zu verstehen, sei deshalb so wichtig. Der Postdoktorand ist ebenfalls Erstautor sowie Leiter der Studie und arbeitet jetzt an der Medizinischen Klinik mit Schwerpunkt für Hepatologie und Gastroenterologie der Charité – Universitätsmedizin Berlin. „Mit Mll1 haben wir einen molekularen Schalter gefunden, der insbesondere die Selbsterneuerung und Teilung von Tumorstammzellen der Darmkarzinome kontrolliert.“
Hoffnung auf effektivere Therapien
Der genetische Knockout eines Gens wie bei der Maus ist im Menschen nicht möglich. In Mäusen kann man die Bildung von Tumorstammzellen über die Zeit verfolgen und es stehen immer genügend Stammzellen für Experimente zur Verfügung. Aber man könnte MII1 mit einem chemischen Medikament blockieren. Für Forschungszwecke wurden bereits entsprechende kleine Moleküle entwickelt, zum Beispiel die Inhibitoren MI-2 und MM-401. Sie binden an essentielle Partnermoleküle von Mll1 und inaktivieren dadurch seine Funktion. „Auf Grundlage der Wirkweise dieser Moleküle wird es möglich sein, diese und klinisch noch wirksamere Mll1-Inhibitoren zu entwickeln und zu testen“, sagt Birchmeier, der Letztautor der Studie ist.
Wir konnten an einem anderen System, an Speicheldrüsenkrebszellen der Maus zeigen, dass Mll1 ausschließlich bei Tumor- und nicht bei gesunden Stammzellen wirksam ist.
Gesunde Stammzellen im Darm werden dabei offenbar nicht blockiert. „Wir konnten an einem anderen System, an Speicheldrüsenkrebszellen der Maus zeigen, dass Mll1 ausschließlich bei Tumor- und nicht bei gesunden Stammzellen wirksam ist,“ sagt Birchmeier. Das mache auch Hoffnung für die Therapie weiterer Krebsarten. Denn auch Kopf-Hals-Tumoren hätten die gleiche Achillesferse, wie Tiermodelle zeigten. „Auf Basis unserer Studien an der Maus laufen an der Uni-Klinik Düsseldorf klinische Studien, um Mll1-Inhibitoren für die Therapie von Kopf-Hals-Tumoren zu bewerten.“
Sollten sie erfolgreich sein, könnten Patient*innen mit Darmkrebs zusätzlich zur Chemotherapie mit Mll1-Inhibitoren behandelt werden, also Therapien, die spezifisch Tumorstammzellen behindern. Dadurch steigen die Chancen auf eine erfolgreiche Therapie – selbst bei fortgeschrittenem Darmkrebs.
Text: Catarina Pietschmann
Weiterführende Informationen
- Krebsstammzellen nachverfolgen
- Nierenkrebs an der Wurzel packen
- Klinik für Hepatologie und Gastroenterologie an der Charité – Universitätsmedizin Berlin
Bild zum Download
"Expandierende Krebsstammzellen (grün) in einem Darmtumor mit onkogen aktiviertem Wnt/beta-Catenin Signalweg (rot)". © AG W. Birchmeier, MDC
Literatur
Johanna Grinat, Julian Heuberger, Walter Birchmeier et al. (2020): „The epigenetic regulator Mll1 is required for Wnt-driven intestinal tumorigenesis and cancer stemness“. Nature Communications, DOI: 10.1038/s41467-020-20222-z
Pressekontakte
Professor Walter Birchmeier
Leiter der Arbeitsgruppe „Signalvermittlung in Entwicklung und Krebsentstehung“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 (0)30 9406 3800
wbirch@mdc-berlin.de
Dr. Julian Heuberger
Wissenschaftlicher Mitarbeiter an der Medizinischen Klinik mit Schwerpunkt Hepatologie und Gastroenterologie
Charité – Universitätsmedizin Berlin
Julian.heuberger@mdc-berlin.de
Christina Anders
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-2118
christina.anders@mdc-berlin.de oder presse@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.