Regeneration im Verdauungstrakt
Der Verdauungstrakt des Menschen beherbergt ein Universum winzigster Lebewesen. Grob geschätzt finden sich im Darm so viele Bakterien, wie es Menschen auf der Erde gibt. Fast immer dienen die Keime dem Wohl ihres Gastgebers. Sie helfen mit, die Nahrung zu verdauen, produzieren Vitamine und trainieren das Immunsystem. Zudem schützen sie, allein durch ihre Anwesenheit, vor krankheitserregenden Artgenossen.
Doch der Mikrokosmos im Darm, das Mikrobiom, ist ein störanfälliges Gebilde. „Gerät es aus dem Gleichgewicht, drohen Infektionen, Übergewicht und Diabetes sowie entzündliche und neurologische Erkrankungen“, sagt Dr. Sofia Forslund, die im Mai dieses Jahres vom European Molecular Biology Lab (EMBL) in Heidelberg ans Max-Delbrück-Centrum für Molekulare Medizin (MDC) in Berlin wechselte und die komplizierten Wechselwirkungen zwischen Mensch und Mikrobiom erforscht.
Unsere Studie ist vermutlich die erste, die den Einfluss von Antibiotika auf die Gene von Bakterien untersucht hat.
Antibiotika hinterlassen im Darm dauerhafte Spuren
In der jetzt in „Nature Microbiology“ veröffentlichten Studie hat Forslund gemeinsam mit Kollegen und Kolleginnen aus Dänemark, Deutschland und China untersucht, wie sich eine Therapie mit Breitband-Antibiotika auf das Zusammenspiel der Darmbakterien auswirkt. „Wir konnten zeigen, dass sich das Mikrobiom ein halbes Jahr nach der Medikamentengabe fast vollständig erholt hatte“, berichtet die schwedische Forscherin. Aber eben nur fast: „Einige empfindliche Bakterienarten blieben dauerhaft verschwunden“, sagt Forslund.
Für die Untersuchung verabreichte das Team um die MDC-Forscherin und zwei Wissenschaftler der Universität Kopenhagen sechs gesunden, jungen Männern, die sich zur Teilnahme an der Studie bereiterklärt hatten, über vier Tage hinweg einen Cocktail aus drei Antibiotika: Meropenem, Gentamicin and Vancomycin. Gewöhnlich kommen diese Wirkstoffe vor allem dann zum Einsatz, wenn gängigere Antibiotika nicht mehr wirken, weil die Bakterien gegen sie bereits resistent geworden sind.
Manche Bakterienarten überlebten die Medikamentengabe
Anschließend untersuchten die Forscherinnen und Forscher das Mikrobiom ihrer Probanden sechs Monate lang. Mittels DNA-Sequenzierung bestimmten sie zum einen, welche Bakterienarten sich im Darm der Männer aufhielten, und zum anderen, welche Gene in den Bakterien vorhanden waren. Besonderes Augenmerk legte das Team dabei auf die Resistenz-Gene, mit denen sich die Keime gegen Medikamente zur Wehr setzen. „Unsere Studie ist vermutlich die erste, die den Einfluss von Antibiotika auf die Gene von Bakterien untersucht hat“, sagt Forslund.
Zunächst einmal habe sich gezeigt, dass der Darm trotz der Verabreichung dreier stark wirksamer Antibiotika nicht vollständig steril geworden sei, berichtet die Forscherin. Unter den verbliebenen Bakterien entdeckte das Team sogar einige bislang unbekannte und noch nicht näher charakterisierte Arten. Andere Keime schrumpften und verwandelten sich zu Sporen – einer Lebensform, in der Bakterien bei schlechten Bedingungen viele Jahre verharren können, ohne ihre ursprünglichen Eigenschaften zu verlieren.
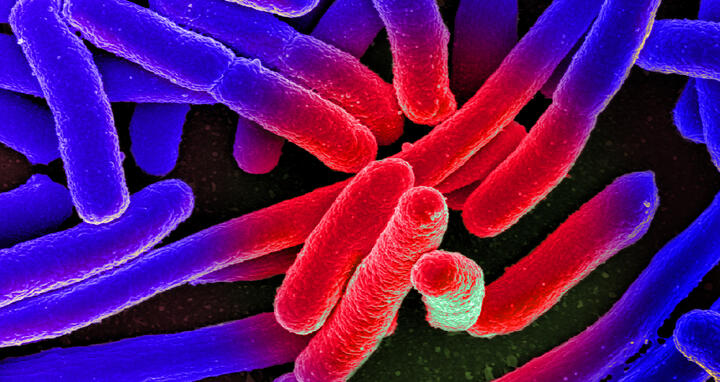
Elektronenmikroskopische Aufnahme von kultivierten Escherichia coli auf einem Objektträger, nachträglich koloriert.
Zuerst tauchten krankmachende Keime auf
Die anschließende Wiederbesiedelung des Darms erfolgte stufenweise. „Ganz ähnlich, wie wenn sich ein Wald nach einem Brand langsam wieder erholt“, sagt Forslund. Zuerst tauchten allerdings vermehrt Bakterien auf, die krankmachende Eigenschaften besitzen, Enterococcus faecalis and Fusobacterium nucleatum beispielsweise. Gleichzeitig konnte das Team in den Mikroorganismen besonders viele Virulenzfaktoren ausmachen – also Strukturen und Stoffwechselprodukte, die dem Menschen eher schaden. „Diese Beobachtung erklärt gut, warum die meisten Antibiotika Magen-Darm-Störungen hervorrufen“, sagt Forslund.
Mit der Zeit normalisierte sich die Darmflora wieder. Die schlechten Keime wurden mehr und mehr durch gute Bakterien wie beispielsweise die Milchsäure produzierenden Bifidobakterien ersetzt, die Krankheitserreger fernhalten. Nach sechs Monaten war das Mikrobiom der Probanden nahezu wieder das alte. Es fehlten jedoch nicht nur ein paar der früher vorhandenen Arten. „Auch die Anzahl der Resistenz-Gene hatte sich in den Bakterien erwartungsgemäß erhöht“, berichtet Forslund. Bakterienarten, die nach der Antibiotikagabe am schnellsten wieder auftaucht waren, wiesen aber erstaunlicherweise nicht die meisten Resistenz-Gene auf. „Diese Erbanlagen spielen anscheinend eher langfristige eine Rolle dabei, den Darm wieder zu besiedeln“, sagt die Forscherin.
Auch das Mikrobiom der Lunge soll weiter erforscht werden
Aufgrund des offenbar dauerhaften Verlusts einzelner Arten und der erhöhten Zahl der Resistenz-Gene zeige die Studie einmal mehr, wie wichtig es sei, Antibiotika mit Bedacht zu verabreichen, betont Forslund. Zudem müsse man weiter erforschen, wie es künftig besser gelingen könne, das empfindliche Mikrobiom vor Schäden durch Antibiotika zu schützen.
Dazu möchte die Wissenschaftlerin beitragen. Am MDC läuft unter ihrer Leitung derzeit zum Beispiel eine Beobachtungsstudie, mit der Forslund herausfinden will, wie sich längerfristige Gaben von Antibiotika auf die Artenvielfalt im Darm auswirken – und ob ein stärkerer Schwund an Spezies das Risiko von Übergewicht und Stoffwechselerkrankungen erhöht. Darüber hinaus will sie erforschen, wie oft Darmbakterien während einer Antibiotikagabe ihre Resistenz-Gene untereinander austauschen. Auch eine Studie, die den Einfluss dieser Medikamente auf das Mikrobiom der Lunge untersucht, ist bereits in Planung.
Literatur
Albert Palleja et al. (2018): „Recovery of gut microbiota of healthy adults following antibiotic exposure.“ Nature Microbiology 3. doi:10.1038/s41564-018-0257-9
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.