T-Zellen brauchen gesunde Zellkraftwerke
Gemeinsame Pressemitteilung von BIH, Charité und Max Delbrück Center
Das Erbgut der Mitochondrien weist bei diesen Patientinnen und Patienten große Lücken auf, was zur Folge hat, dass die Zellen nicht genügend Energie für ihre unterschiedlichen Aufgaben haben.
Patient*innen mit dem Pearson Syndrom leiden an Blutarmut, da ihr Knochenmark zu wenige rote Blutkörperchen bildet. Auch werden Defekte des Immunsystems vermutet, diese wurden bisher aber nicht genauer untersucht. Grund für all diese Probleme sind Fehler im Erbgut der Zellkraftwerke, der Mitochondrien, erklärt Dr. Leif S. Ludwig, Leiter der Emmy-Noether-Nachwuchsgruppe „Stammzelldynamiken und mitochondriale Genomik“ am Berlin Institute of Health in der Charité (BIH) und Max Delbrück Center. Die oft über 100 Mitochondrien pro Zelle besitzen eigene Gene, die vor allem die Energieproduktion regeln. „Das Erbgut der Mitochondrien weist bei diesen Patientinnen und Patienten große Lücken (Deletionen) auf, was zur Folge hat, dass die Zellen nicht genügend Energie für ihre unterschiedlichen Aufgaben haben.“
Mitochondrien in T-Zellen ohne Mutationen
Leif Ludwigs Gruppe gehört zum gemeinsamen Forschungsfokus „Single-Cell-Ansätze für die personalisierte Medizin“, den das BIH in der Charité gemeinsam mit dem Max Delbrück Center und der Charité gegründet hat. Die Wissenschaftler*innen sind spezialisiert auf die Analyse einzelner Zellen und konnten so Blut- und Immunzellen der Patient*innen genauestens untersuchen. „Dabei konnten wir zeigen, dass die krankmachenden Veränderungen im Erbgut der Mitochondrien nicht in allen Zellen gleichermaßen vorhanden waren“, erklärt der Zellbiologe. „In bestimmten Typen von T-Zellen etwa waren die Mitochondrien fast vollständig mutationsfrei. Das hat uns überrascht.“
Leif S. Ludwig erklärt sich die Beobachtung so, dass bei der Aktivierung von T-Zellen, ausreichend Energie über die Mitochondrien zur Verfügung gestellt werden muss, damit diese weiter ausreifen können. „Während einer Abwehrreaktion müssen sich die T-Zellen sehr stark vermehren, und wir denken, dass vor allem diese ersten Zellteilungen ohne gesunde Mitochondrien nicht mehr funktionieren.“
Selektion am Werk
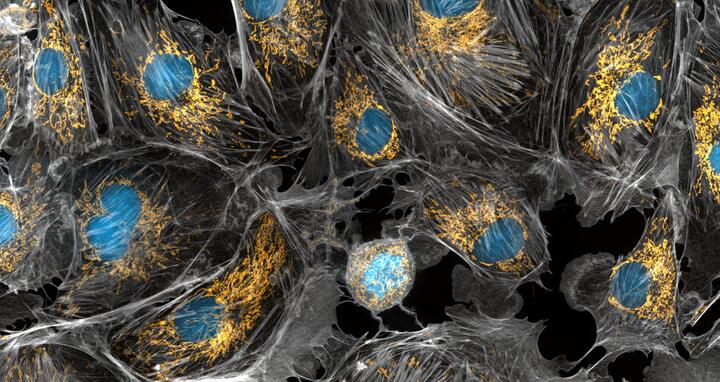
Mitochondrien sind die Kraftwerke der Zellen. Sie erzeugen die Energie, die die Zellen benötigen, um ihre Aufgaben zu erfüllen und um am Leben zu bleiben. Wenn diese Zellorganellen nicht so gut funktionieren, wie sie sollten, entstehen verschiedene Krankheiten. In dieser mikroskopischen Aufnahme von Rinderzellen wurden die Mitochondrien in leuchtendem Gelb gefärbt, um sie in der Zelle sichtbar zu machen. Die großen blauen Punkte sind die Zellkerne und das graue Netz ist das Zytoskelett der Zellen.
Interessanterweise sind aber verschiedene Typen von T-Zellen unterschiedlich stark tolerant gegenüber Defekten im mitochondrialen Genom. Krankhafte Mutationen finden sich häufig in CD4+ T-Gedächtniszellen, aber dafür kaum in CD8+ T-Gedächtniszellen. „Wir erklären uns das so, dass CD8+ T-Zellen die Mitochondrien anders nutzen“, sagt Leif S. Ludwig. „Weil sie dabei auf komplett gesunde Mitochondrien angewiesen sind, sehen wir daher nur CD8+ T-Gedächtniszellen ohne Mutationen. Zellen mit „kranken“ Mitochondrien schaffen es erst gar nicht und werden aussortiert, oder wie wir Zellbiologen sagen: negativ selektiert.“ Worin sich die Mitochondrien unterschiedlicher Zellen genau unterscheiden, wollen die Wissenschaftler*innen nun aktiv weiter untersuchen, da dieses von hoher Relevanz für Patient*innen mit Erkrankungen der Mitochondrien ist.
Die klinische Anwendung seiner Ergebnisse verfolgt Leif S. Ludwig, dessen Gruppe am Berliner Institut für medizinische Systembiologiedes Max Delbrück Center (MDC-BIMSB) angesiedelt ist, unter anderem gemeinsam mit seinen klinischen Partnern an der Charité, unter anderen den Direktoren der Medizinischen Kliniken mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie, Professor Lars Bullinger am Charité Campus Virchow-Klinikum (CVK) sowie Professor Ulrich Keller am Charité Campus Benjamin Franklin (CBF). „Wie therapeutisch wirksam wir eines Tages die Veränderungen im mitochondrialen Genom mit BaseEditing-Technologien angehen oder gar gesunde Mitochondrien transplantieren können, wissen wir noch nicht“, sagt Leif S. Ludwig. „Aber wir denken darüber nach.“
Weiterführende Informationen
Literatur
Yu-Hsin Hsieh et al. (2023): „Single-cell multi-omics of mitochondrial DNA disorders reveals dynamics of purifying selection across human immune cells“. Nature Genetics, DOI: s41588-023-01433-8
Downloads
Porträt von Leif S. Ludwig (© Felix Petermann, Max Delbrück Center)
Pressekontakte
Dr. Stefanie Seltmann
Leiterin Kommunikation & Marketing
Berlin Institute of Health (BIH) in der Charité
+49 (0) 30 450 543019
stefanie.seltmann@bih-charite.de
www.bihealth.org
Christina Anders
Redakteurin, Kommunikation
Max Delbrück Center
+49 30 9406-2118
christina.anders@mdc-berlin.de oder presse@mdc-berlin.de
- Über das Berlin Institute of Health (BIH) in der Charité
-
-
Die Mission des Berlin Institute of Health (BIH) ist die medizinische Translation: Erkenntnisse aus der biomedizinischen Forschung werden in neue Ansätze zur personalisierten Vorhersage, Prävention, Diagnostik und Therapie übertragen, umgekehrt führen Beobachtungen im klinischen Alltag zu neuen Forschungsideen. Ziel ist es, einen relevanten medizinischen Nutzen für Patient*innen und Bürger*innen zu erreichen. Dazu etabliert das BIH als Translationsforschungsbereich in der Charité ein umfassendes translationales Ökosystem, setzt auf ein organübergreifendes Verständnis von Gesundheit und Krankheit und fördert einen translationalen Kulturwandel in der biomedizinischen Forschung. Das BIH wurde 2013 gegründet und wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung (BMBF) und zu zehn Prozent vom Land Berlin gefördert. Die Gründungsinstitutionen Charité – Universitätsmedizin Berlin und Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) waren bis 2020 eigenständige Gliedkörperschaften im BIH. Seit 2021 ist das BIH als so genannte dritte Säule in die Charité integriert, das MDC ist Privilegierter Partner des BIH.
- Max Delbrück Center
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.