Brudermord unter T-Zellen
Ein interessanter, neuer Ansatz im Kampf gegen Krebs ist der Versuch, das Immunsystem des Patienten so zu trainieren, dass es den Tumor bekämpft. Weiße Blutkörperchen namens T-Zellen spielen eine Schlüsselrolle bei der Abwehr von Viren und Parasiten, und Forscher arbeiten daran, sie dazu zu bringen, dass sie auch Tumoren attackieren. Die Idee ist, T-Zellen aus dem Blut von Patienten zu gewinnen und sie mit Molekülen auszustatten, die in der Lage sind, Krebszellen zu erkennen. Diese T-Zellen würden dann schnell im Labor expandiert und dem Patienten zurückgegeben. Die MDC-Arbeitsgruppe von Prof. Dr. Wolfgang Uckert hat jetzt in Zusammenarbeit mit der Gruppe von Prof. Dolores J. Schendel aus dem Helmholtz Zentrum München ein Problem aufgedeckt, das beim Verfolgen dieser Strategie bedacht werden muss. Ihre Arbeit ist in einer der letzten Ausgaben des Journal of Clinical Investigation erschienen.
Menschliche T-Zellen sind in der Lage, Milliarden von Molekülen zu identifizieren – darunter solche von Krankheitserregern und potentiell auch Bestandteile eines Tumors. Dies geschieht mit Hilfe eines T-Zellrezeptors (engl. T cell receptor (TCR)), über den jede T-Zelle verfügt. Diese hochvariablen Moleküle sind in der Lage, bestimmte Proteinfragmente (Antigene) auf der Oberfläche anderer Zellen zu erkennen, die wiederum an einen Proteinkomplex, genannt Haupthistokompatibilitätskomplex (engl. major histocompatibility complex (MHC)), gebunden sind. Diese MHC-Komplexe gibt es beim Menschen in unterschiedlichen Ausprägungen – ein Punkt der später noch von Bedeutung sein wird. Im Körper jeder einzelnen Person sind die MHCs jedoch identisch, und sie kommen auf praktisch jeder Körperzelle vor. Wenn ein Krebsantigen von einem TCR erkannt werden kann, dann eröffnet sich die Möglichkeit für einen neuen Therapieansatz, der als TCR-Gentherapie bezeichnet wird. Dafür werden die Gene, die für einen tumorspezifischen TCR kodieren in T-Zellen transferiert, um sie tumorsensitiv zu machen. Die Gruppen von Prof. Uckert und Prof. Schendel haben Erfahrung darin, T-Zellen herzustellen, die Tumorantigene erkennen können, und sie erforschen deren Potenzial für die Behandlung von Krebserkrankungen.
Ein zentrales Anliegen besteht darin, therapeutische TCRs zu generieren, die ein Antigen erkennen, das spezifisch für den Tumor ist. Mit anderen Worten: Das Antigen sollte nicht bei gesunden Zellen vorkommen, um die Behandlung nicht durch autoimmune Nebenwirkungen zu beeinträchtigen. Problematisch ist dabei, dass Krebs aus körpereigenen Zellen entsteht und weitgehend dem übrigen Körpergewebe gleicht. Deshalb ist es schwierig, geeignete Antigene zu identifizieren. Dennoch sammeln Krebszellen während ihrer Entwicklung eine Reihe von Mutationen an und produzieren mitunter abnorme Mengen bestimmter Proteine. Diese Veränderungen erzeugen Antigene, die als Ziel für die angreifenden T-Zellen dienen könnten.
Kürzlich hat das National Cancer Institute der USA ein Projekt zur Identifikation von Tumorantigenen begonnen, um geeignete Zielantigene für eine Immuntherapie zu definieren. Eines dieser Antigene, das beim Menschen vorkommende Survivin, wurde dabei als besonders wertvoll erachtet, weil es häufig in aggressiven Tumoren vorkommt und in ersten Analysen selten in gesundem Gewebe detektiert werden konnte. Die Funktion von Survivin in Tumorzellen ist es, die Zelle vor der Selbstzerstörung zu schützen, die die meisten defekten Zellen im Körper ereilt. Matthias Leisegang aus der Gruppe von Prof. Uckert hat gemeinsam mit Dr. Susanne Wilde aus der Gruppe von Prof. Schendel, Survivin als Zielantigen verwendet, um die Fähigkeit von T-Zellen zu untersuchen, Tumorzellen zielgerichtet zu zerstören.
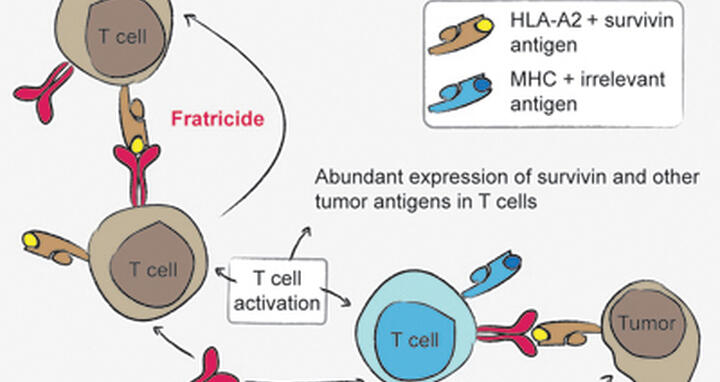
Leisegang, Dr. Wilde und ihre Kollegen haben T-Zellen im Labor generiert, die über survivinspezifische TCR verfügten. Diese TCR sind in der Lage, ein Fragment des Survivinproteins zu erkennen, wenn es durch das MHC-Molekül HLA-A2 auf der Zelloberfläche präsentiert wird. Wurden die TCR-Gene in T-Zellen transferiert, die von anderen Spendern isoliert wurden, konnten die therapeutischen Fähigkeiten in diese T-Zellen übertragen werden. Sie konnten Tumorzellen elimieren und in ausreichender Menge expandiert werden. Allerdings wurde dieses Ergebnis nur erreicht, wenn die T-Zellen einem Individuum entnommen wurden, das nicht über das MHC-Molekül HLA-A2 verfügt. Die Dinge wurden problematisch als versucht wurde, eine Situation nahe am klinischen Einsatzszenario nachzustellen und die TCR-Gene in T-Zellen zu transferieren, die HLA-A2 aufweisen. Überraschenderweise starben diese T-Zellen, als sie im Labor kultiviert wurden.
Zusätzliche Experimente brachten die Ursache für dieses Verhalten an den Tag: Wenn T-Zellen sich vermehren, produzieren sie selbst große Mengen Survivin, was sie selbst genauso zum Angriffsziel der Therapie macht wie den Tumor. Leisegang und Wilde entdeckten, dass dies dazu führt, dass die T-Zellen einander zerstören. Dieser “Brudermord” findet statt, wenn der eingesetzte TCR ein Antigen erkennt, dass über ein MHC-Molekül präsentiert wird, welches die T-Zellen selbst auf der Oberfläche tragen. Man kann diesen Prozess mit einer drastischen Autoimmunreaktion vergleichen. “Ganz offensichtlich verhindert dies eine therapeutische Nutzung,” sagt Prof. Uckert, “denn dasselbe würde passieren, wenn man versucht, patienteneigene T-Zellen für die Therapie zu nutzen.”
Das Phänomen des Brudermords unter T-Zellen gibt wichtige Hinweise bei der Suche nach geeigneten Antigenen, die Angriffsziele für Krebstherapie mit T-Zellen sein können. In ihrer Arbeit haben die Forscher das Vorkommen weiterer interessanter Tumorantigene in T-Zellen analysiert. Die Ergebnisse legen nahe, dass einige dieser Antigene ebenso den T-Zell-Brudermord auslösen könnten. “Das Prinzip unseres Ansatzes ist es, das Immunsystem des Patienten gegen sein eigenes erkranktes Gewebe zu aktivieren, was bedeutet, dass die Zellen unvermeidlich die gleichen MHC-Moleküle exprimieren.” fasst Prof. Uckert zusammen. “Dabei bewegt sich die Therapie auf einem sehr schmalen Grat, weil sie gesundes Gewebe, wie z.B. T-Zellen, nicht schädigen darf. Eine Tumorzelle muss gerade unterscheidbar genug sein, um zum Angriffsziel werden zu können. Unsere Experimente zeigen, dass das schwieriger ist, als wir gehofft haben. Aber wir sind zuversichtlich, dass wir Tumormarker identifizieren können, die sich therapeutisch nutzen lassen.” Das Ergebnis dieser Arbeit unterstreicht, wie wichtig die Auswahl des richtigen Antigens als Angriffsziel für die Entwicklung erfolgreicher Therapien unter Verwendung des körpereigenen Immunsystems ist.
- Russ Hodge
- Übersetzung: Maritta Strasser
Highlight Reference:
Leisegang M, Wilde S, Spranger S, Milosevic S, Frankenberger B, Uckert W, Schendel DJ. MHC-restricted fratricide of human lymphocytes expressing survivin-specific transgenic T cell receptors. J Clin Invest. 2010 Nov 1;120(11):3869-77.