Die Verwandlung eines Chloridionenkanals
Ionenkanäle haben lebenswichtige Funktionen: Sie sorgen dafür, dass Ionen wie Chlorid, Kalium oder Natrium in unsere Körperzellen ein- und ausströmen können. Auf diese Art und Weise wird der Elektrolytgehalt in den Zellen und ihrer Umgebung reguliert und es werden beispielsweise elektrische Signale generiert. Ionenkanäle sind aber auch sehr wichtig für Organellen in den Zellen – sie beeinflussen ihre Funktion maßgeblich. Der Chloridionenkanal ASOR ist einer von ihnen.
Doch bislang weiß man nur wenig über den Acid-Sensitive Outwardly Rectifying Anion Channel – kurz ASOR. Parallel zu einer Gruppe in den USA konnte 2019 das Team von Professor Thomas Jentsch vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und Max-Delbrück-Centrum für Molekulare Medizin (MDC) in Berlin das Gen für den säureempfindlichen Ionenkanal identifizieren. Schon damals war bekannt, dass sich dieser Kanal nur öffnet, wenn die extrazelluläre Umgebung sehr sauer wird. Das ist ungewöhnlich, denn ein derart niedriger pH-Wert kommt normalerweise nur vor, wenn Zellen absterben – etwa bei einem Schlaganfall oder Herzinfarkt.
Bis heute ist unklar, warum praktisch alle menschlichen und tierischen Zellen diesen Ionenkanal besitzen. Neuere Daten weisen darauf hin, dass ASOR eine wichtige Rolle in intrazellulären Vesikeln spielt. Diese Bläschen weisen normalerweise einen pH auf, der sauer genug ist, um ASOR zu aktivieren. Der Mechanismus dieser Aktivierung sowie die Struktur der Pore, durch die Chloridionen strömen können, waren bisher unbekannt. Doch erst wenn diese Eigenschaften aufgeklärt sind, würde ein Design von Wirkstoffen möglich, die ASOR beeinflussen. In enger Zusammenarbeit mit Strukturbiolog*innen in New York konnten die Berliner Forscher*innen nun neue wichtige Erkenntnisse gewinnen: Zum ersten Mal überhaupt haben sie die Struktur des offenen Kanals gezeigt sowie einen neuen Aktivierungsmechanismus identifiziert.
Struktur des offenen Kanals beschrieben
Das Team um Professor Steve Long am Memorial Sloan Kettering Cancer Institute erhielt mit Hilfe von Kryo-Elektronenmikroskopie hochauflösende Strukturen des Kanals bei verschiedenen pH-Werten. Aus einem Vergleich dieser Strukturen haben sie Modelle für die Funktion des Kanals abgeleitet, die die Berliner Arbeitsgruppe mit Hilfe des Austauschs einzelner Aminosäuren und anschließender elektrophysiologischer Analyse überprüfte.
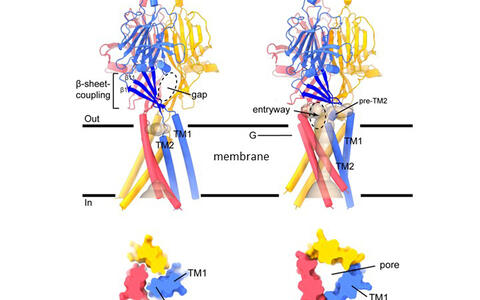
„Was wir gefunden haben, ist für einen Ionenkanal ziemlich ungewöhnlich“, sagt Post-Doktorandin Maya Polovitskaya aus der AG Jentsch. Sie ist eine der Erstautorinnen der Studie. „Wenn sich der pH-Wert ändert, kontrahiert die extrazelluläre Domäne des Kanals, die dadurch an Membran-durchquerenden spiralförmigen Segmenten des Kanalproteins zieht. Im Gegensatz zu anderen Kanälen, bei denen die Öffnung der Pore nur mit relativ kleinen Veränderungen der Position einzelner oder weniger Aminosäuren einhergeht, sehen wir bei ASOR eine drastische Veränderung des Membrananteils des Kanals. Wir nennen diesen Prozess Transmembranmetamorphose. Er führt dazu, dass sich eine Pore bildet, durch die Chlorid fließt. Diese Umbildung unterscheidet sich eklatant von der Öffnung anderer bekannter Kanäle.“
Was die Metamorphose des Kanals anstößt
Struktur des ASOR-Kanals in der geschlossenen und offenen, säureaktivierten Konfiguration. ASOR besteht aus drei identischen TMEM206-Proteinen. Jedes Protein durchquert die Membran zweimal. Während der Öffnung wird das Protein erheblich umstrukturiert. So bildet sich eine zentrale Pore (hellbraun dargestellt, oben rechts), durch die das Chlorid-Ion passieren kann. Ein Querschnitt auf der Ebene G – innerhalb der Membran – ist unten dargestellt. Bild: Ausschnitte aus Bild 2.
Die Forscher*innen verglichen die Kanalstrukturen bei neutralem und saurem pH und entdeckten so auch den zugrundeliegenden Aktivierungsmechanismus. Pro Untereinheit des aus drei gleichen Proteinen zusammengesetzten Kanals gibt es in der extrazellulären Domäne drei Paare von negativ geladenen Aminosäuren. Sie stoßen sich normalerweise elektrisch ab. Bei saurem pH, das heißt einer hohen Konzentration von H+ (Protonen), lagern sich diese positiv geladenen Partikel zwischen die negativen Seitenketten der Aminosäurepaare und ‚kleben‘ diese zusammen. Dadurch kommt es zur oben beschriebenen Kontraktion des extrazellulären Teils – und die Membranpore bildet sich. Dies erklärt die starke pH-Abhängigkeit von ASOR.
Der seit Jahrzehnten bekannte Natriumkanal ASIC wird ebenfalls durch sauren pH geöffnet. Der Mechanismus der pH-Sensitivität und die Iris-ähnliche Öffnung der Pore von ASIC unterscheiden sich aber grundlegend von ASOR. „Wir haben in unserer Arbeit neue Mechanismen entdeckt. Das ist die Grundlage, um ASOR-beeinflussende Substanzen zu entwickeln“, sagt Polovitskaya.
Was bleibt, ist die Frage: Wozu ist ASOR eigentlich gut? Eine Gruppe aus den USA konnte vor einiger Zeit zeigen, dass der Ionenkanal eine fatale Rolle beim Schlaganfall spielt. Knock-out-Mäuse, bei denen ASOR abgeschaltet war, überstanden den Hirnschlag mit weniger bleibenden Schäden als ihre Artgenossen mit funktionsfähigem Kanal.
Zelltod kann nicht der einzige Zweck von ASOR sein
„ASOR spielt definitiv eine Rolle bei Säure-induziertem Zelltod. Aber nun rückt eine Rolle in intrazellulären Prozessen, zum Beispiel beim Transport von Vesikeln, mehr in den Vordergrund“, sagt Jentsch. Er hat schon etliche Ionenkanäle entdeckt, deren biologische Funktionen beschrieben und einige davon als Krankheitsgene entlarven können. Darum ist der Forscher zuversichtlich, eines Tages auch das Rätsel um ASOR zu lösen. „Wir haben jetzt schon Anhaltspunkte, dass eine Hemmung des Kanals das Absterben von Gehirnzellen beim Schlaganfall abmildern könnte. Aber als Grundlagenforscher wollen wir natürlich auch die biologische Funktion im gesunden Organismus verstehen“, meint Jentsch. „Und dieser spannenden Frage bleiben wir auf den Fersen.“
Text: FMP
Weiterführende Informationen
Literatur
Chongyuan Wang, Maya M. Polovitskaya et al. (2022): „Gating choreography and mechanism of the human proton-activated chloride channel ASOR“. In: Science Advances, DOI: 10.1126/sciadv.abm3942