Wie eine Mutation das Herz krank macht
Wenn der Herzmuskel krankhaft vergrößert ist, kann das Herz nicht mehr richtig pumpen. Es schlägt unregelmäßig; Atemnot, Ödeme und Erschöpfung sind die Folge. Nach und nach wird das Herz so schwach, dass der Mensch stirbt. In manchen Familien tritt eine solche Dilative Kardiomyopathie (DCM) gleich mehrfach auf, und oft ist bei den Patientinnen und Patienten das Gen für das Protein Lamin A/C verändert. Doch was hat ein Protein, das die Hülle für Zellkerne bildet, mit der linken Herzkammer zu tun? Diese Frage beantwortete kürzlich ein Forschungsteam um Joseph Wu und Jaecheol Lee von der Stanford Universität im Fachmagazin „Nature“. Dr. Sebastian Diecke, der Leiter der Stammzellplattform am Max-Delbrück-Centrum für Molekulare Medizin (MDC) und am Berliner Institut für Gesundheitsforschung (BIH), ist einer der drei Erstautoren. Er war bis 2014 Postdoktorand in Wus Labor, auch danach hat er die Studie bis zur Veröffentlichung begleitet.
In vielen anderen Studien geht es nur um Teilaspekte einer Erkrankung. Hier konnten wir zeigen, wie die Mutation die Krankheit auslöst – mit Stammzellen und mit Gewebe von einem Patienten. Schließlich haben wir sogar einen Angriffspunkt gefunden, über den bestimmte Medikamente die Rhythmusstörungen lindern können.
„In vielen anderen Studien geht es nur um Teilaspekte einer Erkrankung. Hier konnten wir zeigen, wie die Mutation die Krankheit auslöst – mit Stammzellen und mit Gewebe von einem Patienten. Schließlich haben wir sogar einen Angriffspunkt gefunden, über den bestimmte Medikamente die Rhythmusstörungen lindern können“, sagt Diecke. Bis dahin war es allerdings ein langer Weg.
Patientenspezifische Stammzellen
Sieben Mitglieder einer betroffenen Familie – fünf von ihnen krank und zwei gesund – hatten dem Team Haut- und Blutzellen zur Verfügung gestellt. Diese programmierten die Forscherinnen und Forscher zuerst in induzierte pluripotente Stammzellen (ipS-Zellen) um und differenzierten sie dann in Herzmuskelzellen (Kardiomyozyten). Die Zellen der fünf Patientinnen und Patienten mit einem veränderten Gen für Lamin A/C schlugen auch in der Petrischale unregelmäßig. Elektrophysiologische Untersuchungen zeigten, dass der Kalziumhaushalt dieser Zellen aus dem Gleichgewicht geraten war.
Dass wirklich das veränderte Gen für Lamin A/C für die Rhythmusstörungen verantwortlich war, überprüften die Forscherinnen und Forscher mithilfe einer Genomeditierung. Sie setzten eine normale Variante des Gens in das Erbgut der kranken Zellen ein und eine Variante mit patientenspezifischen Mutationen in das Erbgut gesunder Zellen. Der Effekt war eindeutig. Doch der zugrundeliegende Mechanismus war mit diesen Experimenten noch nicht geklärt.
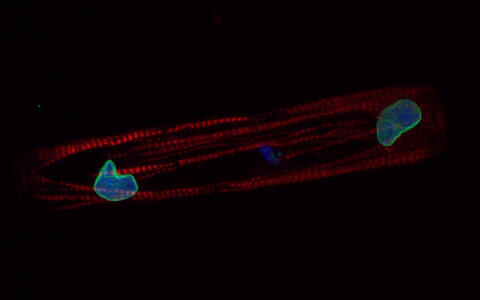
Die Hülle um die Zellkerne war verformt
Im nächsten Schritt schaute sich das Team daher die Hülle um die Zellkerne der kranken Kardiomyozyten genauer an. Tatsächlich bildeten die Zellen nicht genug Lamin A/C und die Zellkerne erschienen nicht mehr rund, sondern erheblich eingebuchtet. Diese Verformung könnte beeinflussen, wie eng der zwei Meter lange Erbgutstrang im Zellkern gepackt ist und welche DNA-Abschnitte abgelesen werden. Die Wissenschaftlerinnen und Wissenschaftler verglichen daher die Genexpression in den gesunden und den kranken Zellen und fanden fast 240 Gene, die bei den kranken Herzmuskelzellen stärker aktiviert waren.
Hochauflösende mikroskopische Aufnahme einer einzelnen Herzmuskelzelle, in welcher ein herzmuskelspezifisches Gen (TNNT2) sowie eine spezifische Kernfärbung zu sehen sind.
Bei der erkrankten Zelle (KO/Mut) sind strukturelle Veränderungen der Zellkern Morphologie zu erkennen, welche unmittelbar im Zusammenhang mit der Ausprägung der Erkrankung stehen.
Viele dieser Gene deuteten auf einen Signalweg für den Wachstumsfaktor PDGF hin, den Platelet-derived growth factor. Er steuert unter anderen die Bildung von Blutgefäßen und ist während der Differenzierung von Herzmuskelzellen aktiv, sollte im gesunden Herzen aber weitgehend stillgelegt sein. Erst unter Stress kommt er wieder ins Spiel und wird mit Fibrosen in Verbindung gebracht. „Einem Patienten aus der Familie, die wir untersucht haben, musste während der Studie ein Herzschrittmacher implantiert werden. So bekamen wir zusätzlich eine Probe seines Herzgewebes“, berichtet Diecke. Im Gewebe des Patienten wurden genau dieselben Gene öfter abgelesen wie bei den in der Petrischale gezüchteten kranken Kardiomyozyten. Außerdem zeigte sich, dass PDGF ein Protein steuert, das den Kalziumhaushalt der Zellen reguliert.
Eine neue Anwendung für zugelassene Krebsmedikamente?
Ob damit die Ursache für die gefährliche Krankheit gefunden war, testete das Team mit Crenolanib und Sunitinib, zwei Wirkstoffen gegen Krebs. Sie binden an einen PDGF-Rezeptor und blockieren so den Signalweg. Tatsächlich schlugen die so behandelten Herzmuskelzellen wieder regelmäßig – auch wenn sich am fehlenden Lamin A/C und der verformten Hülle nichts geändert hatte.
„Vielleicht kann man mit bereits zugelassenen Krebsmedikamenten wie Sunitinib, Sorafinib oder Axitinib auch Patientinnen und Patienten mit Dilativer Kardiomyopathie behandeln“, sagt Diecke. Allerdings muss zunächst die richtige Dosis gefunden werden. Denn die Wirkstoffe haben bei Krebskranken eine unerwünschte Nebenwirkung: Sie können dem Herz schaden. „Mit dem Wissen um die relevante Andockstelle kann man natürlich auch nach einer sichereren Alternative suchen. Es ist eine Chance – und ich bin froh, dass ich Teil dieses Teams war.“
Text: Jana Schlütter
Weiterführende Informationen
Literatur
Jaecheol Lee, Vittavat Termglinchan, Sebastian Diecke et al. (2019): „Activation of PDGF pathway links LMNA mutation to dilated cardiomyopathy“. Nature, doi: 10.1038/s41586-019-1406-x.