Millionen für die Krebsforschung
Thomas Blankenstein
Der Europäische Forschungsrat (European Research Council, ERC) fördert Professor Thomas Blankenstein mit 2,5 Millionen Euro über fünf Jahre. Insgesamt zeichnet der ERC dieses Jahr 185 Wissenschaftler*innen aus ganz Europa mit einem Advanced Grant aus.
„Ich freue mich, eine neue Runde von ERC-Finanzhilfen anzukündigen, die Spitzen- und Sondierungsforschung unterstützen und Europa und der Welt helfen sollen, besser für die Zukunft gerüstet zu sein. Das ist die Rolle der Grundlagenforschung“, sagt Professor Mauro Ferrari, der Präsident des ERC in einer offiziellen Mitteilung am 31. März 2020. „Diese hochrangigen Spitzenforscher werden neue Wege in unterschiedlichen Forschungsbereichen gehen, auch im Feld der Gesundheit. Ich wünsche ihnen bei diesem Vorhaben alles Gute und möchte in dieser Zeit der Krise die heroische und unschätzbare Arbeit der gesamten wissenschaftlichen Gemeinschaft würdigen".
In Blankensteins Arbeitsgruppe untersuchen Wissenschaftler*innen am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und der Charité – Universitätsmedizin Berlin spezielle Zellen des Immunsystems, die T-Zellen. Mit seinem neuen Forschungsvorhaben will Blankenstein herausfinden, wie sich diese T-Zellen im Körper verhalten, wenn ihr spezifischer Rezeptor ein neues Antigen auf einer Krebszelle erkennt. Die Forschenden wollen so neue Ansätze für Immuntherapien gegen Krebs entwickeln.
Schwierige Bedingungen für die Erforschung von Immunüberwachung
Die Theorie zur Immunüberwachung diskutieren Wissenschaftler*innen bereits seit etwa 50 Jahren. Der australische Virologe Sir Frank MacFarlane Burnet vermutete 1970, dass das Immunsystem ständig nach Krebszellen Ausschau halte, um diese zu zerstören. Nach seiner Hypothese erkennen T-Zellen den Tumor an bestimmten Merkmalen, die auf der Oberfläche der Krebszellen präsentiert werden. „Es gibt keinen Zweifel, dass T-Zellen oft Krebs anhand dieser Antigene erkennen und die entarteten Zellen zerstören“, sagt Blankenstein. Der Wissenschaftler geht davon aus, dass dies zwar bei Krebs, der durch Viren hervorgerufen werde, der Fall sei. Bei anderen Krebsarten sei jedoch unklar, ob eine Immunüberwachung stattfindet. „Bei spontanem Krebswachstum im Körper wissen wir bislang nicht sicher, ob dies tatsächlich ein Vernichtungsprogramm in den T-Zellen aktiviert“, sagt er.
Blankenstein arbeitet bereits seit Jahren an Immuntherapien gegen Krebs. „In unserem neuen Forschungsprojekt wollen wir herausfinden, wie eine T-Zelle reagiert, sobald sie ein Tumorantigen erkennt“, sagt Blankenstein. Er will wissen: „Veranlasst die T-Zelle dann die Zerstörung der Krebszellen? Gibt es demnach Immunüberwachung auch bei Krebs, der spontan im Körper entsteht?“
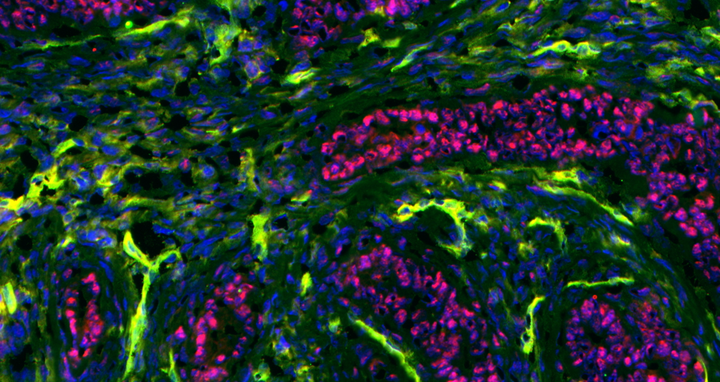
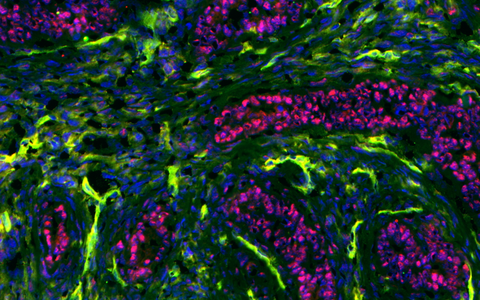
Krebs besteht nicht nur aus Krebszellen (rot), sondern auch aus Stromazellen einschließlich Immunzellen (grün).
Um diese Fragen zu beantworten, braucht Blankenstein einen neuen Forschungsansatz. Herkömmliche Forschungsmodelle hätten immer einen Haken, sagt er. Bislang untersuchten zum Beispiel viele Wissenschaftler*innen die Immunüberwachung in Mäusen, indem sie Tumorwachstum in einer normalen Zelle auslösten, beispielsweise mit chemischen Substanzen. Das Problem dabei erklärt der Immunologe so: „Entweder spiegeln solche Forschungsmodelle nicht das Tumorwachstum beim Menschen wider oder wir können nicht klar sagen, wie und ob das T-Zell-Verhalten tatsächlich den Tumor beeinflusst.“
Ein vielversprechendes Forschungsmodell
Stattdessen will Blankenstein zukünftig Tumore in die Maus transplantieren. Dafür hat er zwei Modelle entwickelt, für die er einige Hürden überwinden musste: Das größte Problem sei, dass ein invasiver Eingriff, wie eine Transplantation, immer Entzündungen in der Maus hervorrufe, erklärt er. Aber woher solle man dann wissen, ob die T-Zelle nur auf das Tumorantigen reagiere, weil ein Eingriff ins Gewebe stattgefunden hat. Blankensteins Arbeitsgruppe ist es nun gelungen, diesen Störfaktor zu beseitigen und Untersuchungsbedingungen ohne diese Entzündungsreaktionen zu schaffen. Sie spiegeln die sporadische Krebsentwicklung bei Menschen wider. Seine Mausmodelle hat er bislang noch nicht veröffentlicht und sollen in seinem neuen Projekt erstmals zum Einsatz kommen. Sie erlauben es ihm nicht nur, das Verhalten von T-Zellen bei der Krebserkennung zu messen, sondern auch zu regulieren, welche Tumorantigene die Krebszellen auf ihrer Oberfläche präsentieren.
Das Projekt könnte unseren Blick auf die Immunüberwachung bei spontanem Tumorwachstum verändern.
Blankenstein plant nun, neue Stellen für Postdocs und Promovierende zu besetzen, die ihn bei seinem neuen Forschungsvorhaben unterstützen. Er sagt: „Das Projekt könnte unseren Blick auf die Immunüberwachung bei spontanem Tumorwachstum verändern.“
Über die ERC Grants
Das Förderprogramm des ERC gehört zu den bedeutendsten in Europa. Seit 2009 werden ERC Advanced Grants an alle Fachrichtungen vergeben. Sie sind mit bis zu 2,5 Millionen Euro über fünf Jahre dotiert.
Weiterführende Informationen
Downloads
Statistik: ERC Advanced Grants
Portraitbild von Thomas Blankenstein, Foto: David Ausserhofer / MDC
Krebs besteht nicht nur aus Krebszellen (rot), sondern auch aus Stromazellen einschließlich Immunzellen (grün). Foto: Blankenstein Lab, MDC
Pressekontakte
Professor Thomas Blankenstein
Leiter der Arbeitsgruppe „Molekulare Immunologie und Gentherapie“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Direktor des Instituts für Immunologie
Charité - Universitätsmedizin Berlin
tblanke@mdc-berlin.de
Christina Anders
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-2118
christina.anders@mdc-berlin.de oder presse@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.