Die Gangschaltung von Tumorzellveränderungen
Tumorzellen können viel Stress haben. Sie müssen sich gegen Attacken des Immunsystems oder Krebstherapien behaupten. Um andere Gewebe zu besiedeln, müssen sie sich aus ihrem Zellverband lösen, in die Blutbahn eintreten, die Reise durch den Körper überleben. Die Blutgefäße wieder verlassen und sich erneut niederlassen. Die Fähigkeit von Zellen, sich mit ihren Eigenschaften an all diese Herausforderungen anzupassen, nennt sich Plastizität. Bei epithelialen soliden Tumoren einschließlich der sehr häufigen Lungen-, Brust-, Dickdarm- und Bauchspeicheldrüsenkrebsarten nutzen die Tumorzellen dafür einen zellulären Entwicklungsprozess, der als epithelial-mesenchymale Transition (EMT) bekannt ist.
Unsere Ergebnisse können dazu beitragen, therapeutische Strategien zu entwerfen, mit denen den Ausweichtaktiken von Tumorzellen ein Riegel vorgeschoben werden kann.
Die EMT wird häufig mit Kinasen in Verbindung gebracht – Enzymen, die wie ein Schalter biochemische Vorgänge in den Zellen an- oder abdrehen. Wissenschaftler*innen um Dr. Gaetano Gargiulo am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) in Berlin haben nun herausgefunden, dass eine weitere Klasse von Proteinen, die Chromatin-Modulatoren, eine zentrale Rolle bei der EMT spielt. Damit haben sie einen entscheidenden Einfluss darauf, wie sich Tumorzellen verändern. „Unsere Ergebnisse können dazu beitragen, therapeutische Strategien zu entwerfen, mit denen den Ausweichtaktiken von Tumorzellen ein Riegel vorgeschoben werden kann“, sagt Erstautorin Dr. Michela Serresi. Die Studie ist im Fachjournal Science Advances erschienen.
Kombination aus CRISPR und molekularem Reporter
Die EMT macht die Tumorzellen so wandelbar, weil dabei ihre Polarität und die Bindungen untereinander aufbrechen. Die EMT ist ein zellulärer Prozess, bei dem sich Epithelzellen in mesenchymale Zellen umwandeln. Epithelzellen haben einen festen Zellpol und sind miteinander verknüpft. Mesenchymale Zellen hingegen sind eher spindelförmig, haben eine flexible Zellpolarität und keine festen Verbindungen untereinander. Der fließende Übergang zwischen Epithel- und Mesenchymalzellen spielt eine wichtige Rolle in der Entwicklung von Embryonen. Gemeinsam mit dem umgekehrten Vorgang, der mesenchymal-epithelialen Transition, ermöglicht die EMT beispielsweise, dass sich während der Embryogenese aus der Neuralleiste das periphäre Nervensystem entwickelt. Dieser Prozess ist also die Voraussetzung dafür, dass die Zellen im menschlichen Organismus verschiedene Formen und Funktionen annehmen können. Doch so lebenswichtig die EMT ist, so zerstörerisch kann sie sein. Bei soliden Tumoren befähigt sie die Tumorzellen dazu, sich aus ihrem Zellverbund zu lösen und durch den Körper zu wandern.
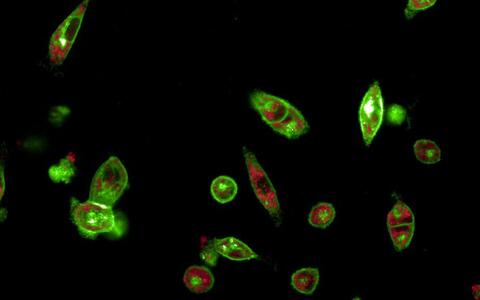
Lungenkrebszellen, die sich vom epithelialen zum mesenchymalen Phänotyp wandeln, sichtbar durch das grüne Fluoreszieren des molekularen Reporters.
Dem Steuerungsmechanismus dieses Prozesses konnten die Wissenschaftler*innen mithilfe einer Kombination aus einem molekularen Reporter und dem CRISPR-Interferenz-Screening auf den Grund gehen. Der molekulare Reporter basiert auf DNA-Abschnitten, die so umgewandelt worden sind, dass sie fluoreszieren, wenn in den Tumorzellen komplexe Prozesse ablaufen und sie zum Beispiel ihre Zellidentität ändern. In ihrer Studie konnten die Forschenden die EMT in Lungenkrebszellen mit einem Medikament beeinflussen und die Veränderung der Zellidentität mithilfe des molekularen Reporters beobachten.
„Identitätsänderungen von Krebszellen sind selten eine Einbahnstraße“
Anschließend untersuchten sie Hunderte von Kinasen und Chromatin-Proteinen auf ihre Fähigkeit, den molekularen Reporter zu beeinflussen. Chromatin ist das Material, aus dem die Chromosomen bestehen. Es sorgt dafür, dass bestimmte Gene in manchen Zellen an- und in anderen ausgeschaltet sind. Auf diese Weise bestimmt das Chromatin die Identität der Tumorzellen, etwa ob sie epithelial oder mesenchymal sind. Diese Identitäten sind nicht in Stein gemeißelt, sondern können sich verändern – von epithelial zu mesenchymal und umgekehrt. „Identitätsänderungen von Krebszellen sind selten eine Einbahnstraße“, sagt Gargiulo.
Wenn die Chromatin-Proteine also den Subtyp der Tumorzellen bestimmen – regulieren sie dann auch die Transformation vom einen zum anderen Subtyp? Wie? Und welche Proteine sind einflussreicher? Um das herauszufinden, schnitt Serresi mit der Genschere CRISPR einzelne Chromatinstücke von den Zellgenen ab. In einigen Fällen, je nachdem, welche Proteine dabei stillgelegt wurden, reagierten die Tumorzellen, indem sie ihre Identität in die epitheliale oder mesenchymale Richtung veränderten. „Im Grunde genommen bestimmen die Chromatin-Proteine die Plastizität der Tumorzellen, indem sie ihre Identität in die eine oder andere Richtung schieben, ihr Halt geben oder sie wegstoßen“ schlussfolgert die Forscherin.
Kinasen blasen zum Aufbruch – Chromatine bestimmen die Marschrichtung
Während die Kinasen so etwas wie das Gaspedal für die EMT sind, bilden die Chromatinproteine die Gangschaltung, die das Tempo und die Richtung der Zellplastizität vorgeben.
Damit haben die Chromatine einen viel größeren Einfluss auf die EMT als bislang angenommen. „Während die Kinasen so etwas wie das Gaspedal für die EMT sind, bilden die Chromatinproteine die Gangschaltung, die das Tempo und die Richtung der Zellplastizität vorgeben“, umschreibt Gargiulo diesen Prozess.
„Mit dieser Erkenntnis kommen wir der Präzisionskrebstherapie ein Stück näher“, sagt der Wissenschaftler. „Denn wir verfügen damit über ein In-vitro-System, mit dem wir nicht nur die Auswirkungen einer Behandlung auf die Tumorzellen beobachten können, sondern auch, wie sie versuchen zu überleben, indem sie ihre Identität verändern.“ Ein detailliertes Verständnis der molekularen Mechanismen hinter der Plastizität von Krebszellen kann dazu beitragen, therapeutische Strategien zu entwickeln, die ihren Ausweichmanövern entgegenwirken.
Weitere Informationen
Literatur
M. Serresi, S. Kertalli, L. Li, M. J. Schmitt, Y. Dramaretska, J. Wierikx, D. Hulsman, G. Gargiulo (2021): “Functional antagonism of chromatin modulators regulates epithelial-mesenchymal transition”, in: Science Advances, DOI: 10.1126/sciadv.abd7974
Download
Lungenkrebszellen, die sich vom epithelialen zum mesenchymalen Phänotyp wandeln, sichtbar durch das grüne Fluoreszieren des molekularen Reporters.
© AG Gargiulo
Kontakte
Dr. Michela Serresi
Teamleiterin in der AG Molekulare Onkologie
Max Delbrück Center für Molekulare Medizin in der Helmholt-Gemeinschaft (MDC)
michela.serresi@mdc-berlin.de
Dr. Gaetano Gargiulo
Leiter der Arbeitsgruppe „Molekulare Onkologie“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
gaetano.gargiulo@mdc-berlin.de
Jana Ehrhardt-Joswig
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
jana.ehrhardt-joswig@mdc-berlin.de oder presse@mdc-berlin.de