Gendefekt führt bei Frauen eher zu Herzschwäche
Einer Herzmuskelschwäche kann eine angeborene Herzmuskelerkrankung, eine Kardiomyopathie, zugrunde liegen. Die Ursachen sind vielfältig, darunter zum Beispiel ein angeborener Defekt des Gens PRDM16, wie Professorin Sabine Klaassen und ihre Kolleg*innen bereits 2013 zeigen konnten. Ein Team um Klaassen und Dr. Jirko Kühnisch vom Max Delbrück Center und der Charité – Universitätsmedizin Berlin untersuchte am gemeinsamen Experimental and Clinical Research Center (ECRC) diesen Defekt bei Mäusen nun näher.
Das Ergebnis: Ist das PRDM16-Gen mutiert, verändert das den Stoffwechsel der Herzmuskelzellen, wodurch das Herz schwächer wird. Weibliche Mäuse mit dem Gendefekt sind deutlich stärker von der Herzkrankheit betroffen als männliche, berichten die Wissenschaftler*innen in „Cardiovascular Research“. „Das Ergebnis ist überraschend, denn üblicherweise leiden Männer stärker und früher an genetisch bedingter Herzschwäche als Frauen“, sagt Klaassen, die auch als Kinderkardiologin mit Schwerpunkt Kardiogenetik am Deutschen Herzzentrum der Charité (DHZC) arbeitet.
Herzmuskel pumpt nicht mehr richtig
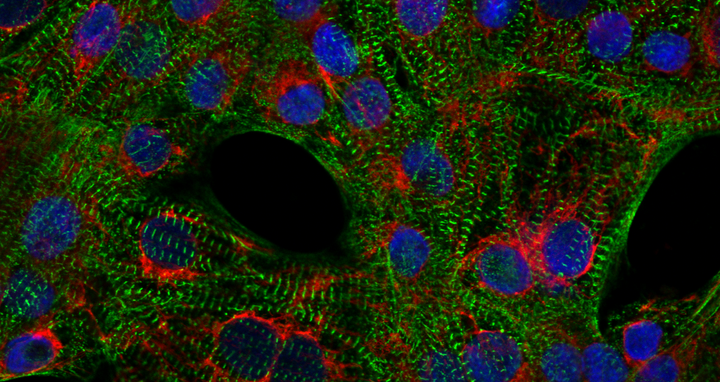
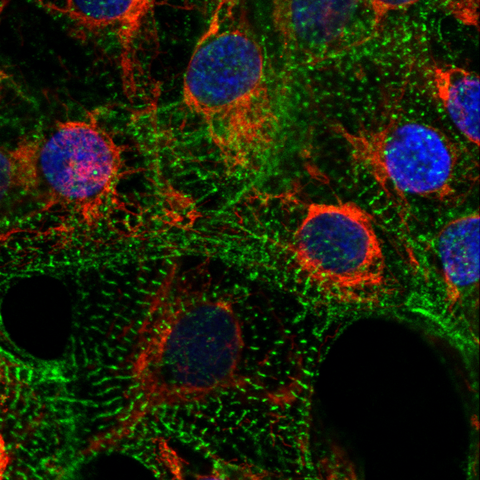
Kardiomyozyten mit angefärbten Mitochondrien (rot), Sarkomeren (grün) und Zellkernen (blau).
In Experimenten mit Mäusen, die ab 2016 durchgeführt und vom Berlin Institute of Health in der Charité (BIH) gefördert wurden, konnte das Team nun eindeutig bestätigen, dass Mutationen im PRDM16-Gen die Herzschwäche verursachen. Zusätzlich fanden die Forschenden den dahinter liegenden Mechanismus: Die Deaktivierung des PRDM16-Gens verändert den Fett- und Glukosestoffwechsel der Herzzellen. Das führt schließlich dazu, dass der Herzmuskel schwammartig wird, sich erweitert und nicht mehr richtig pumpen kann. „Die geschlechtsspezifischen Unterschiede könnten darauf hindeuten, dass sich der Stoffwechsel von Männer- und Frauenherzen unterscheidet“, sagt der Erstautor Kühnisch.
Dass der PRDM16-Gendefekt zu einer metabolischen Herzinsuffizienz führen kann, ist nun in einer Gendatenbank hinterlegt, die Mediziner*innen für die Diagnostik verwenden können. „Bekommt ein Kardiologe einen entsprechenden Befund, kennt er die Ursache für die Herzerkrankung“, erklärt Klaassen. Sie fügt hinzu: „Wir denken, dass die genetischen Veränderungen in schwächerer Ausprägung auch für Herzschwäche, die erst im Alter auftritt, relevant sein könnten.“ Beide Wissenschaftler*innen sind mit dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK) affiliiert, das die Untersuchungen maßgeblich mitgefördert hat.
Text: Janosch Deeg
Weiterführende Informationen
- Pressemeldung: Neues Gen für Herzinsuffizienz entdeckt
- PRDM16 – ein Zielprotein zur Behandlung von Herzinsuffizienz
Literatur
Jirko Kühnisch et al. (2023): „Prdm16 mutation determines sex-specific cardiac metabolism and identifies two novel cardiac metabolic regulators“. Cardiovascular Research, DOI: 10.1093/cvr/cvad154
Downloads
Kardiomyozyten mit angefärbten Mitochondrien (rot), Sarkomeren (grün) und Zellkernen (blau). Foto: AG Klaassen, Max Delbrück Center
Kontakte
Prof. Dr. Sabine Klaassen
Leiterin der Arbeitsgruppe „Klinische Kardiogenetik“
Experimental and Clinical Research Center (ECRC),
Max Delbrück Center und Charité – Universitätsmedizin Berlin
+49 (0)30 9406-3319
klaassen@mdc-berlin.de
Jana Schlütter
Redakteurin, Kommunikation
Max Delbrück Center
+49 (0)30 9406-2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Max Delbrück Center
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.