📺 Nieren-Puzzle für Fortgeschrittene
Video: Christian Hinze über neues Paper
Um herausfinden, was wann genau in einer bestimmten Zelle passiert, sehen sich Wissenschaftler*innen deren Transkriptom an – die Gesamtheit aller Gene, die zu einem konkreten Zeitpunkt abgelesen und in RNA umgeschrieben werden. Mit Hilfe der Einzelzell-RNA-Sequenzierung lassen sich heute die Expressionsprofile vieler Tausend Zellen parallel analysieren. Doch dazu müssen sie aus dem Zellverband herausgelöst werden. Die Information wo eine Zelle vorher im Gewebe saß, geht dabei verloren.
Anhand der Genexpression lässt sich dies jedoch bioinformatisch rekonstruieren. „Wir wollten wissen, ob man Algorithmen nutzen kann, um neben einer Rekonstruktion der räumlichen Anordnung auch funktionelle Informationen aus den Einzelzellsequenzierungen zu gewinnen. Zum Beispiel über die Umgebungsbedingungen von Nierenzellen“, sagt Dr. Christian Hinze von der Arbeitsgruppe Molekulare und translationale Nierenforschung am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und von der Charité – Universitätsmedizin Berlin. Er ist Erstautor der Studie, die nun im „Journal of the American Society of Nephrology“ (JASN) erschienen ist.
Ein heterogenes Organ
Über 15 verschiedene Zelltypen finden sich zum Beispiel in einer Mäuseniere – und manche davon in allen drei Zonen der Niere.
Die Nieren von Säugetieren sind räumlich sehr heterogen. Die beiden bohnenförmigen Organe bestehen aus der Nierenrinde (Kortex), sowie dem äußeren und inneren Nierenmark (Medulla). In letzterem bildet sich nach diversen Filterprozessen hochkonzentrierter Urin, der über Harnleiter und Blase ausgeschieden wird. „Über 15 verschiedene Zelltypen finden sich zum Beispiel in einer Mäuseniere – und manche davon in allen drei Zonen der Niere“, sagt Hinze. Ein unlösbares Problem? Keineswegs. Denn die Umgebung, in der eine Zelle lebt, spiegelt sich auch in ihrer Genexpression wider.
2019 hatte das Team um Professor Nikolaus Rajewsky, Direktor des Berliner Instituts für Medizinische Systembiologie (BIMSB) des MDC und einer der Letztautoren des aktuellen Papers, das Programm NovoSpaRc entwickelt. Damit kann man die räumliche Anordnung von Zellen innerhalb eines Organs anhand der Genexpression rekonstruieren. Bei ersten Studien hatten die Forschenden herausgefunden, dass Zellen, die nah beieinander liegen, sich auch in der Aktivität bestimmter Gene ähneln. „Das liegt daran, dass sie in der gleichen Umgebung zurechtkommen müssen“, erklärt Hinze. „Im inneren Nierenmark etwa herrschen sehr viel heftigere Bedingungen als in der Nierenrinde. Denn die Osmolalität der Umgebung – also die Konzentration der gelösten Substanzen in der Umgebung der Zellen – nimmt von außen nach innen stark zu.“
Der Algorithmus löst das 3D-Puzzle
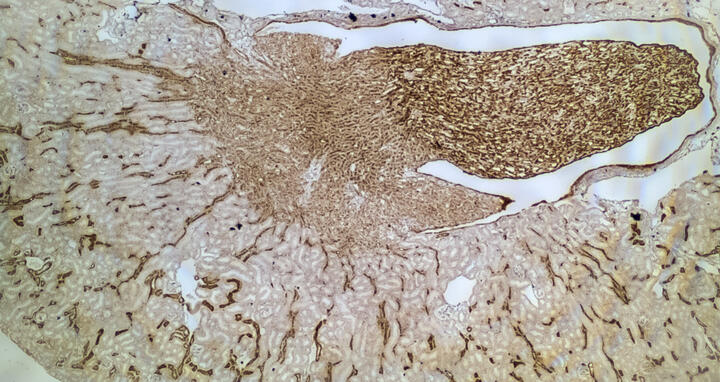
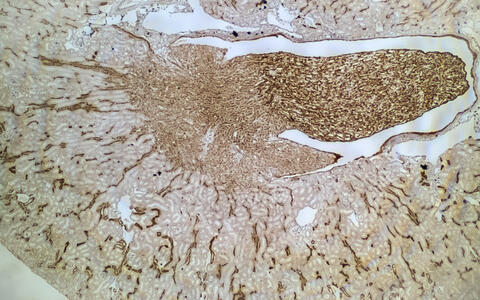
Schnitt durch eine Mausniere: Die Boten-RNA eines Gens ist braun angefärbt. Je intensiver die Färbung, desto stärker ist die Genexpression. Dies verdeutlicht die räumlich heterogene Expression von Genen in der Niere.
Für ihre aktuelle Studie konzentrierten sich die Forschenden vorrangig auf einen bestimmten Zelltyp in der Niere. Auf Prinzipalzellen, die maßgeblich an der Rückresorption von Blutsalzen und Wasser beteiligt und über das ganze Organ verteilt sind. Diese Zellen haben sie anhand der speziellen Genexpression dieses Zelltyps aus den Einzelzelldaten von Mausnieren extrahiert und dann dem Algorithmus NovoSpaRc unterworfen. Der ordnete die Expressionsdaten nach Ähnlichkeit von über 800 ausgewählten Genen an. „NovoSpaRc arbeitet wie ein Puzzlespieler: Er versucht, die verschiedenen Teile (Zellen) so zusammenzubringen, dass das Ergebnis einen Sinn ergibt“, sagt Bioinformatiker Dr. Nikos Karaiskos aus dem Rajewsky-Labor. Er ist Mitentwickler von NovoSpaRc, und leitet das DFG-geförderte Projekt Unverfälschte räumliche Einzelzelltranskriptomik.
Und tatsächlich, es funktionierte. „Dass die Osmolalität im Gewebe entlang der Achse von Nierenrinde zum inneren Mark stark zunimmt, sahen wir auch an der Genexpression“, sagt Hinze. „Bei höheren Salzkonzentrationen schaltet die Zelle bestimmte Schutzgene an, damit sie in dieser Umgebung überleben kann.“ Durch Vergleichstests an Gewebe von genetisch veränderten Mäusen, bei denen der normale Salzgradient gestört ist, verifizierten die Forschenden das Ergebnis.
Atlas der Genexpression in der Niere
Inwiefern bringt die räumliche Einzelzellanalyse nun konkret die Nierenforschung weiter? „Wir können Nierenzellen nun die räumliche Genexpression in der Niere genauer vorhersagen und dadurch auch auf Funktionen bzw. Fehlfunktionen in bestimmten Regionen der Niere rückschließen“, sagt Professor Kai Schmidt-Ott, Nephrologe an MDC und der Charité und ebenfalls Letztautor. „In einem ersten Schritt konnten wir bereits einen räumlich hochaufgelösten Atlas der Genexpression der gesunden Mausniere erstellen können, den wir nun der wissenschaftlichen Community online zugänglich machen.“
In einer Minute durchforstet der Algorithmus die Daten einiger Tausend Zellen. Die Rekonstruktion der kleinen Mausniere war jedoch schon binnen weniger Sekunden abgeschlossen.
Die bisherigen Datenanalysen beschränken sich auf gesunde und genetische veränderte Nieren aus Tiermodellen. Jetzt wollen die Forschenden sich kranken Nieren zuwenden. „Wir denken, dass uns die neuen Methoden auch ein besseres Verständnis der regionalen molekularen Prozesse bei Nierenkrankheiten ermöglichen können“, sagt Schmidt-Ott.
Die Rekonstruktion dauerte nur Sekunden
Die Einzelzell-RNA-Sequenzierung mit bioinformatischer Gewebsrekonstruktion zu kombinieren, hat in mehrfacher Hinsicht Charme. Zum einen, weil es normalerweise mehrerer Experimente bedarf, um verschiedene Regionen eines Organs zu studieren. „Wir können einfach die gesamte Niere zerkleinern, sequenzieren und alles Mögliche aus den Transkriptomen ablesen. Das erspart der Forschung viel Zeit und Geld“, betont Hinze. Untersuchen lässt sich damit praktisch alles, was sich in der Genexpression einer Zelle widerspiegelt – und das sogar in räumlicher Auflösung. Etwa die Sauerstoff- oder Nährstoffversorgung des Gewebes oder – wie hier – die Osmolalität. Besonders spannend ist jedoch, dass bereits archivierte Datensätze zur Beantwortung neuer Forschungsfragen herangezogen werden können – selbst wenn die Proben der entsprechenden Zellen schon längst nicht mehr existieren.
Und ein letzter Pluspunkt: Das Puzzeln mit Expressionsdaten geht rasant schnell, wie Karaiskos sagt. „In einer Minute durchforstet der Algorithmus die Daten einiger Tausend Zellen. Die Rekonstruktion der kleinen Mausniere war jedoch schon binnen weniger Sekunden abgeschlossen.“
Text: Catarina Pietschmann
Weiterführende Informationen
- Atlas der Genexpression der gesunden Mausniere
- Sonderforschungsbereich 1365 Nephroprotektion
- Pressemitteilung „3D-Landkarten der Genaktivität“
- Einzelzellanalyse am MDC
Literatur
Christian Hinze et al. (2020): „Kidney Single-cell Transcriptomes Predict Spatial Corticomedullary Gene Expression and Tissue Osmolality Gradients“. JASN, DOI: 10.1681/ASN.2020070930.
Fotos zum Download
Schnitt durch eine Mausniere: Die Boten-RNA eines Gens ist braun angefärbt. Je intensiver die Färbung, desto stärker ist die Genexpression. Dies verdeutlicht die räumlich heterogene Expression von Genen in der Niere. Foto: AG Schmidt-Ott, MDC.
Kontakte
Christina Anders
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-2118 christina.anders@mdc-berlin.de oder presse@mdc-berlin.de
Dr. Christian Hinze
AG Molekulare und translationale Nierenforschung
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-309406-2633 christian.hinze@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.