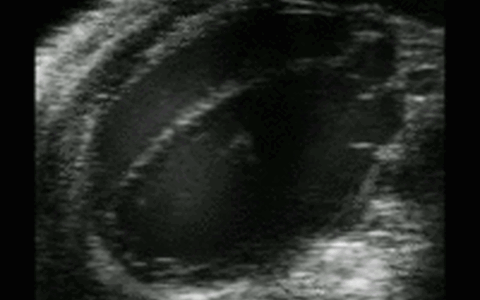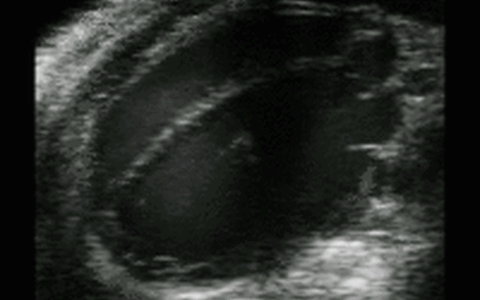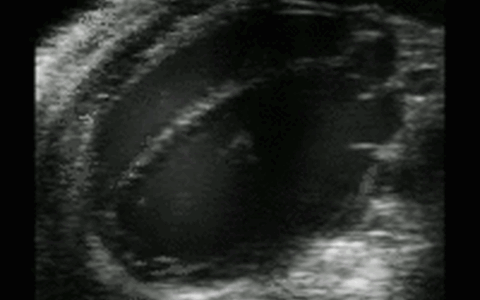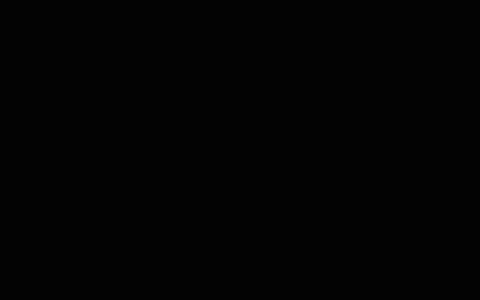
Hochfrequenz Ultraschall
Die Verwendung von Ultraschall bietet die einzigartige Möglichkeit, beinahe alle Organe und vaskulären Strukturen eines Versuchsobjektes abzubilden ohne anhaltenden Schaden zu verursachen. Die Methode der Sonographie wird dementsprechend bereits seit mehreren Jahrzehnten erfolgreich in der klinischen Humandiagnostik eingesetzt.
Dabei erfolgt die Bildgebung im Ultraschall nach einem einfachen physikalischen Prinzip:
Eine Schallwelle von bestimmter Energie und Wellenlänge wird von einer Schallsonde, dem sogenannten Transducer, in das zu untersuchende Gewebe gesandt. Die Schallenergie breitet sich im Körper wellenförmig aus und durchläuft dabei verschiedene Schichten von Geweben und Organen. Dabei breitet sich die Schallenergie abhängig von der Dichte des Gewebes unterschiedlich schnell aus. Gleichzeitig wird, ebenfalls abhängig von der Gewebedichte, unterschiedlich viel Schallenergie in Form eines Echos reflektiert. Diese reflektierten Echosignale werden von der Ultraschallsonde aufgezeichnet und aus der Korrelation von Energiegehalt des Signals und zeitlicher Detektion wird schließlich ein anatomisches Schnittbild entlang der Schallachse erstellt.
Durch den technischen Fortschritt der letzten Jahre ist es gelungen, neue Schallsonden zu bauen, die in der Lage sind, immer höhere Schallfrequenzen im Bereich mehrerer MHz zu erzeugen. Hierdurch werden die zeitliche und räumliche Auflösung der Bildgebung ganz erheblich erweitert. Daher lässt sich diese Technologie des Hochfrequenz-Ultraschalls nun auch im Kleintiermodell und damit der präklinischen Forschung nutzbringend anwenden.
In der Pathophysiologie Facility bieten wir die Möglichkeit, sonographische Aufnahmen und Studien von Kleintieren durchzuführen und dabei eines der weltweit fortschrittlichsten Hochfrequenz-Ultraschall-Systeme zu nutzen, das Vevo®2100 von VisualSonics. Mit Frequenzen bis zu 70MHz lassen sich noch Strukturen von nur 30 µm darstellen, bei einer zeitlichen Auflösung von maximal 740 fps. Somit erfüllt dieses System die optimalen technischen Voraussetzungen für den Einsatz in der präklinischen Forschung und erlaubt die in vivo Untersuchung von vielen Organen und Geweben ohne anhaltend schädigende Auswirkung auf den Organismus zu haben. Lediglich eine leichte Narkose ist notwendig, um das Tier während der Aufnahme ruhig zu stellen und vor dem Stress der kurzzeitigen Bewegungseinschränkung zu bewahren.
- Aufnahme Modi
-
-
Bildgebung mit Hochfrequenz-Ultraschall
Biologische Abläufe und Eigenschaften wie zum Beispiel der Blutfluss, die Wandstärke von Gefäßen oder die Herzfunktion können mit Hilfe vieler verschiedener bildgebender und –verarbeitender Methoden im Hochfrequenz-Ultraschall sichtbar gemacht und untersucht werden. In der Pathophysiologie Facility sind hierfür verschiedene Ultraschallsonden der MicroScan™ Serie von VisualSonics verfügbar, die einen Frequenzbereich von 9 bis 70 MHz abdecken. Eine besonders hohe räumliche und zeitliche Auflösung wird hierbei durch VisualSonics „weltweit erste ultra-hoch frequente lineare Array Technologie“ der Schallsonden erreicht.
So lassen sich Strukturen in verschiedenen Tiefen im Körper untersuchen, vom subkutanen Tumor bis zum Herz, den Nieren oder anderen abdominalen Organen.
Mit Hilfe dieser fortschrittlichen Technik sowie computergestützter Bilddatenrekonstruktion sind wir in der Lage, dreidimensionale Abbildungen von Organen und Geweben zu erstellen und deren Entwicklung über die Zeit zu verfolgen. Dies ist zum Beispiel für die Untersuchung der Vaskularität während des Tumorwachstums sehr nützlich.
An der Pathophysiologie Facility verfügen wir über ein breites Anwendungsspektrum etablierter Protokolle zur Phänotypisierung von Mäusen und Ratten.
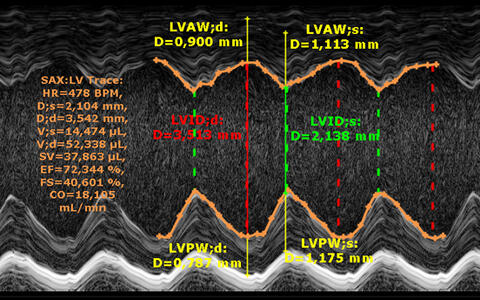
Für kardiovaskuläre Studien kann der Hochfrequenz-Ultraschall z.B. zur Detektion lokaler und globaler Hypertrophien oder Herzwand-Dilatationen des linken Ventrikels genutzt werden. Ebenso lassen sich lokale oder organweite Bewegungsanomalien im Herzzyklus feststellen, die zu systolischen Dysfunktionen führen können.
Mit Hilfe des Transmitralklappen-Dopplers lässt sich abnormales Füllverhalten während der Diastole erfassen, das als Indiz für diastolische Dysfunktionen dienen kann.
Strain Analysen bieten eine hoch-sensitive Methode der Echokardiographie- Auswertung, um die Geschwindigkeit des sich bewegenden Myokards, dessen räumliche Verlagerung sowie Strain und Strain-Rate zu bestimmen. In Kombination mit Time-to-Peak Analysen bilden diese die Grundlage für eine sensitive Herzfunktionsdiagnostik.
Auf Grund der generellen nicht-Invasivität des Ultraschalls kann dieser sehr gut für longitudinale Studien genutzt werden. Besonders für Verlaufsstudien der Karzinogenese, aber auch der Embryonalentwicklung, z.B. für einen Trächtigkeitsnachweis (ab ca. 5dpc), ist diese Methode bestens geeignet.
Ebenso nutzbringend für die Tumorforschung und andere Fragestellungen ist die Möglichkeit, genaue volumetrische Bestimmungen verschiedener Kompartimente mit Hilfe der dreidimensionalen Ultraschalldarstellung vornehmen zu können.
Hier eine kurze Übersicht der verschiedenen Aufnahmemodi, die zur Untersuchung unterschiedlichster Fragestellungen genutzt werden können:
Herzschlag eines gesunden Menschen (animiert)
B-Modus
Zweidimensionales Schnittbild entlang der Schallachse einer anatomischen Struktur
EKV-B-Modus
Hochauflösende Aufnahmen des B-Modes durch EKG-getaktete multiple Herzzyklus- Abgleichung
3D-B-Modus
Mechanisch unterstützte Aufnahme serieller B-Modes in verschiedenen Ebenen mit anschließendem 3D-Rendering
M-Modus
Abbildung der Bewegung entlang der Schallachse, z.B. zur Bestimmung der kardialen Wandstärken während Systole und Diastole
Pulsed Wave Doppler
Spezielle Ultraschallmethode zur Bestimmung der Flussgeschwindigkeiten nach dem Doppler-Prinzip
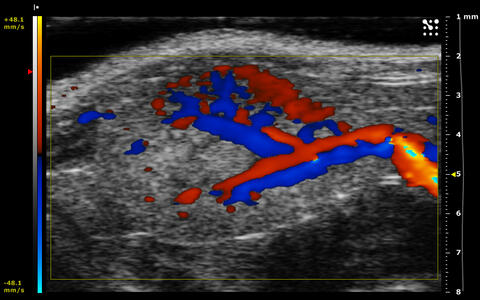
Farb-Doppler
Parametrische Darstellung der relativen Flussgeschwindigkeiten in Richtung oder entgegen der Schallausbreitung
Power-Doppler
Parametrische Darstellung der relativen Geschwindigkeiten ohne konkrete Richtungskomponente, z.B. für die Gefäßdarstellung. Kompatibel für 3D-Aufnahmen!
Gewebe-Doppler
Messung der Bewegung innerhalb eines Gewebes als Faktor für die Kontraktilität und Elastizität
Kontrast Modus
Bildverarbeitende Methode zur Visualisierung eines echogenen Kontrastmittels, um besonders kleine Gefäßstrukturen sichtbar zu machen und die Perfusion zu quantifizieren
- Messwerte
-
-
Messwerte im Hochfrequenz-Ultraschall
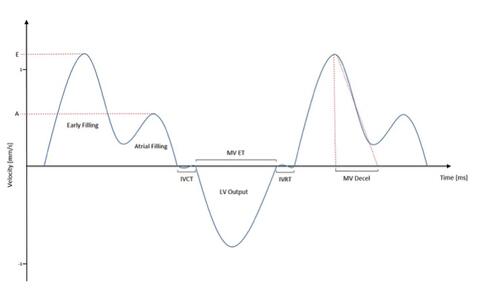
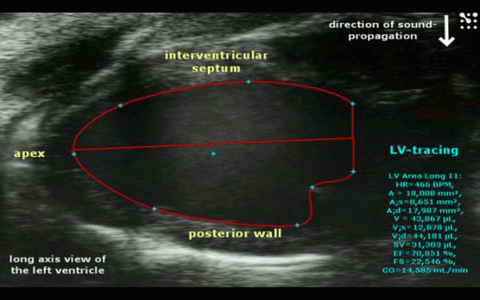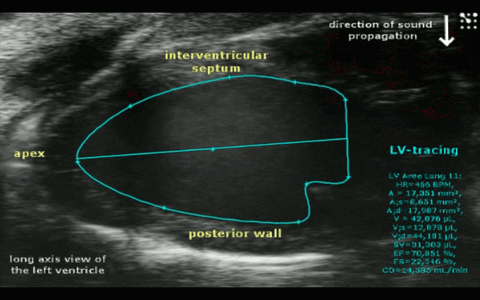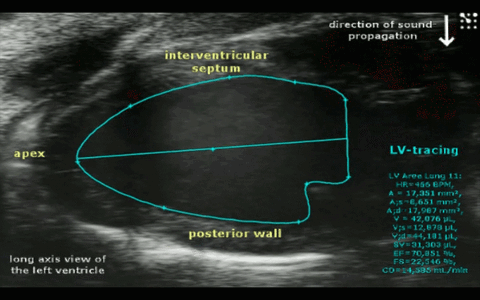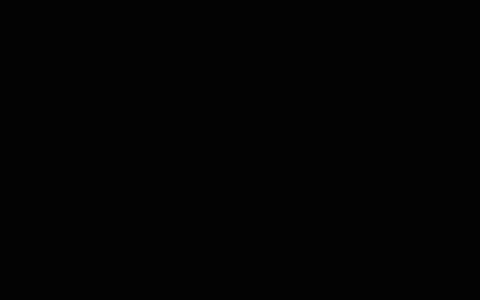
Abbr. Parameter Unit HR Herzrate bpm EF trace/simp Ejektionsfraktion (traced oder Simpson- berechnet) % FS Fraktionale Verkürzung % SV Schlagvolumen µl CO Herzminutenvolumen ml/min IVS-s/d Wanddicke des interventrikulären Septums (systolisch/diastolisch) mm LVPW-s/d Wanddicke der linksventrikulären Hinterwand (systolisch/diastolisch) mm LVID-s/d Innerer linksventrikulärer Durchmesser (systolisch/diastolisch) mm LV Mass Masse der linken Herzkammer (berechnet) mg RVarea-d Rechtsventrikuläre Fläche in kurzer Achse (diastolisch) mm² RVFW-d Wanddicke der rechtsventrikulären freien Wand (diastolisch) mm E Maximalgeschwindigkeit in früher Füllphase mm/s A Maximalgeschwindigkeit in atrialer Füllphase mm/s E/A Quotient der Füllgeschwindigkeiten IVRT Isovolumetrische Relaxationszeit ms IVCT Isovolumetrische Kontraktionszeit ms MV Decel Zeit der Geschwindigkeitsabnahme während der E-Phase ms MV ET Auswurfzeit ms Tei Myokardialer Leistungsindex (Tei- Index) Schematische Darstellung der Messwerte im Mitral-Doppler
Die Geschwindigkeit des Blutes, das während des Herzzyklus durch die Mitralklappe in den linken Ventrikel gelangt und aus diesem wieder durch die Aortenklappe ausgestoßen wird, kann mit Hilfe der Power-Doppler Methode im Hochfrequenz-Ultraschall bestimmt werden. Ein häufig für diagnostische Zwecke verwendetes Geschwindigkeitsmuster ergibt sich, wenn man diese Doppler-Bestimmung unmittelbar an der Mitralklappe vornimmt. Eine grob vereinfachte Darstellung eines solchen Geschwindigkeitprofils an der Mitralklappe ist in der Darstellung links schematisch dargestellt.
Positiven Geschwindigkeiten bedeuten einen Einstrom des Blutes durch die Mitralklappe in den linken Ventrikel während der Diastole. Negative Geschwindigkeiten (entgegengesetzte Flussrichtung) ergeben sich prinzipiell durch den Ausstrom des Blutes durch die Aortenklappe und sind in nebenstehender Darstellung nur exemplarisch dargestellt (LV Output). Kenngrößen der diastolischen Funktion (Füllgeschwindigkeiten E und A, IVRT, IVCT...) können aus einem solchen Geschwindigkeitsprofil für diagnostische Zwecke abgeleitet werden.
- Kontrastmittel im Ultraschall
-
-
Kontrastmittel im Hochfrequenz-Ultraschall
Durch die Verwendung von echogenen Kontrastmitteln im Ultraschall kann das Signal-Rausch-Verhältnis erheblich verbessert und damit der Blutfluss viel besser vom umgebenden Gewebe abgegrenzt werden. Die in der Ultraschallbildgebung verwendeten Kontrastmittel (VisualSonics, MikroMarker®) sind nicht gewebegängig und verbleiben damit während der gesamten Untersuchungszeit im Blut. Mit speziellen Antikörpern beladen, können diese Kontrastmittel so als Detektoren endovaskulärer Biomarker, wie z.B. VEGFR2, genutzt werden. Eine Quantifizierung dieser Biomarker ist so mit Hilfe von Ultraschall in vivo möglich und bietet hervorragende Möglichkeiten für longitudinalen Verlaufsstudien mit minimalen Tierzahlen.
Die in der Ultraschallbildgebung verwendeten Kontrastmittel bestehen aus kleinen, gasgefüllten Bläschen, die mit einer Lipid- oder Polymerschicht versehen sind. Die Bläschen (Microbubbles) beginnen unter Einwirkung von Schall zu oszillieren. Diese Oszillation erzeugt ein wesentlich stärkeres Echosignal als das umliegende Gewebe und ist daher leicht von diesem zu unterscheiden.
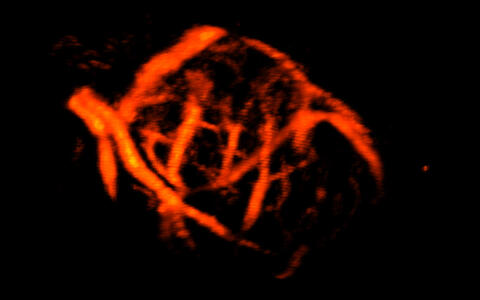
Dabei sind die Microbubbles selbst nur ca. 1-2 µm groß. Sie verbleiben im Blutstrom und verstärken so die Signale durchflossener Gefäße immens. Hervorragend nutzen lässt sich dieser Umstand zum Beispiel zur Visualisierung von Mikrogefäßsystemen und damit zur Einschätzung der Malignität von Tumoren.
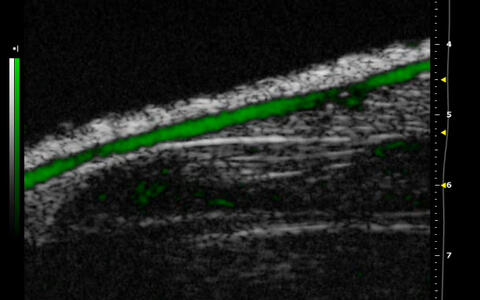
Strukturen der Mikrovaskulatur eines murinen Hodens, hervorgehoben durch 3D-Power-Doppler Aufnahme. Die Verabreichung von Kontrastmitteln führt zu einer drastischen Verstärkung des Power-Doppler Signals und damit zu einer wesentlich detaillierteren Ansicht des Gefäßsystems.
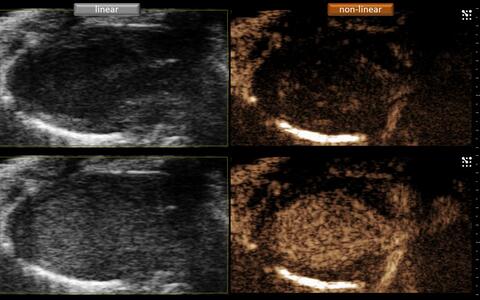
Das einzigartige nicht-lineare Signalverhalten der Ultraschall-Kontrastmittel hebt sich deutlich von den ansonsten linearen Signalen des Gewebes ab. Linear bedeutet hier grob, dass sich die Energie des Echosignals proportional zur Energie des anregenden Schalls verhält. Die Frequenz des Echos ist dabei praktisch dieselbe wie die des anregenden Schalls.
Bei den im Gegensatz zum Gewebe (gefüllt mit Flüssigkeit) gasgefüllten Kontrastmitteln kommt es bei Anregung durch Schallwellen zunächst zu einer deutlichen Erhöhung der Echointensität (Bildausschnitt unten links). Das Signalverhalten der Kontrastmittel unterschiedet sich auch durch das Auftreten verschiedener Nebenfrequenzen, sogenannter harmonischer Frequenzen, zusätzlich zur ursprünglichen Hauptfrequenz. Diese können durch Echtzeitverarbeitung in der sogenannten harmonischen Bildgebung durch Verwendung geeigneter Filter als Echosignal sichtbar gemacht werden und erhöhen damit ungemein das Kontrastverhalten zwischen durchflossenen Arealen und nicht-durchströmten Bereichen (Bildausschnitt unten rechts).
Dieses Verhalten ist beispielsweise hervorragend zur Quantifizierung der Myokard- oder Nierenperfusion geeignet.
Drastische Verstärkung des Echosignals durch Gabe von Ultraschallkontrastmittel (unten links). Die Grenzen des Myokards können sehr gut durch Verwendung des nicht-linearen Signals in der harmonischen Bildgebung abgegerenzt werden (unten rechts).
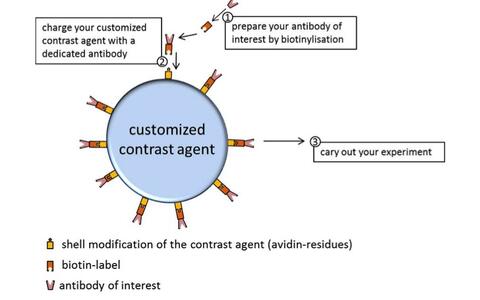
Maßgeschneiderte Kontrastmittel
Vorbereitung von speziellen, gerichteten Kontrastmitteln
Mit bestimmten Antikörpern, gekoppelt an Ultraschallkontrastmittel, gelingt es spezifische Oberflächenproteine von Blutgefäßen zu quantifizieren. Diese Detektionsmethode kann genutzt werden, um Veränderungen in der Proteinexpression zu beobachten, die etwa bei entzündlichen Prozessen, der Entstehung verschiedener Krankheiten oder als Antwort auf eine Veränderung durch äußere Einflüsse erfolgen.
Diese in vivo Detektion durch Ultraschallkontrastmittel eröffnet viele neue Möglichkeiten, den Verlauf der Markerexpression im lebenden Tier auf nicht-invasive Weise zu verfolgen. Ultraschallkontrastmittel bieten daher eine ebenso fortschrittliche wie geeignete Methode der nicht-invasiven in vivo Detektion von Biomarkern und liefern viele Vorteile hinsichtlich der experimentellen Abläufe, der tierschutzrechtlichen Aspekte und damit auch der Versuchszulassung.
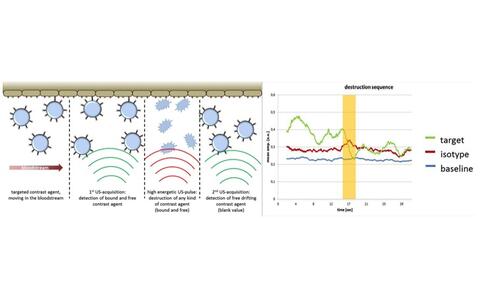
Links: Schematische Darstellung einer Aufnhamestrateige zur Rezeptorquantifizierung mittels Ultraschallkontrastmittel. Rechts: Aufgezeichente Signalintensitäten eines gerichteten Kontrastmittels mit gekoppelten Antikörpern (grün), einer ungerichteten Isotypenkontrolle (rot) und des Baseline-Signals ohne Kontrastmittel (blau). Das Signal des gerichteten Kontrastmittels, das an passende Antigene der Gefäßwand gebunden hat, schwindet nach der Zerstörung der Kontrasmittelbläschen durch einen hochenergetischen Schallimpuls (gelber Bereich). Zurück bleibt eine Echointensität auf dem Niveau der Isotypenkontrolle, hervorgerufen von frei im Blutstrom befindlichem Kontrastmittel, das (noch) keine Binung mit passenden Antigenen eingegangen ist.
- Strain Analyse
-
-
Beim Durchdringen von Gewebe brechen sich die Wellen des Ultraschalls und im Bild des Echosignals entstehen charakteristische Interferenzmuster, sogenannte Speckles. Diese Muster helfen bei der Abgrenzung verschiedener Gewebetypen und Organe voneinander. In Geweben mit intrinsischer Bewegung verändern sich die Speckle-Muster zudem auch abhängig von dieser Bewegung. So lassen sich im Ultraschall unterschiedliche Zonen der Gewebebewegung anhand unterschiedlicher Speckle-Muster identifizieren. Ein gesund durchbluteter Bereich des Herzmuskels mit normaler Kontraktilität weist zum Beispiel ein anderes Muster auf als durch einen Infarkt geschädigte Bereiche mit geringerer Kontraktilität. Man unterscheidet hier die generelle Bewegung des Herzmuskels relativ zur diastolischen oder systolischen Lage (Displacement) von der intrinsischen Bewegung, also innerhalb des Muskelgewebes selbst (Strain). Displacement und Strain sowie deren Geschwindigkeitskomponenten sind inzwischen anerkannte und wichtige Kenngrößen der Kontraktilität und der Herzmuskelfunktion. Eine Reduzierung der Strainwerte zeigt übereinstimmend mit Untersuchungen im EEG, MRI oder per Histologie den Verlust von Kontraktilität z.B. im Zuge infarktbedingter Schädigung mit hoher Sensitivität an.
In der Pathophysiologie Facility nutzen wir die computergestützte Postprocessing-Software Vevo-Strain™ (VisualSonics) zur Evaluierung myokardialer Veränderungen mittels Strain-Analyse. Hierzu werden die relevanten Werte der Bewegungsgeschwindigkeit, Displacement, Strain und Strain-Rate bestimmt. Außerdem können Time-to-Peak Analysen dieser Parameter zur Einschätzung der Synchronität erstellt werden. Graphisch kann die Entwicklung des Strains während eines Herzzyklus als parametrische (3D-)Darstellung ausgegeben werden.
Hier ein Beispiel für die Verwendung von Strain-Analysen im Infarktmodell:
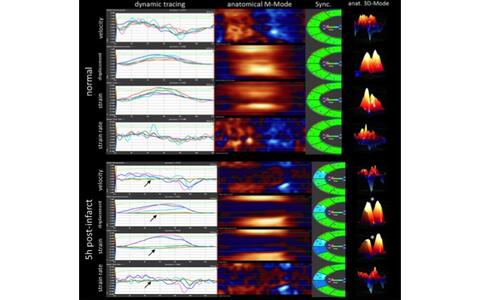
Übersichtsdarstellung einer Strain-Analyse im murinen Infarktmodel.
Im dynamischen Tracing (links, Liniendiagramme) werden die Parameter der typischen Herzregionen der vorderen basalen (blau) und mittigen (rot) Herzwand, des Apex (grün) sowie der hinteren basalen (pink) und mittigen (türkis) Herzwand dargestellt. Zu beachten ist hier der komplett akinetische Bereich der vorderen, mittleren Herzwand (Pfeile) 5h nach Infarktsetzung. Die dazugehörigen anatomischen M-Mode Darstellungen zeigen an dieser Stelle typische Muster akinetischen Verhaltens mit Beeinträchtigung der Umliegenden Bereiche. Die Kartendarstellung der Synchronität (Sync.) zeigt im betreffenden Bereich eine Synchronitätsabweichung von 40 ms (Pfeilspitze). Im 3D-anatomischen M-Mode ist der Verlust der Kontraktilität ebenfalls eindrucksvoll zu erkennen (Sternchen).
Strain Analyse eines induzierten Myokardinfarkts
Das VIDEO verdeutlicht, wie eine Strain-Analyse vor und nach myokardialem Infarkt erfolgt. In der B-Mode Aufnahme werden zunächst die Myokardgrenzen eingezeichnet (grün), die daraufhin von der Software mittels Speckle-Tracking während des Herzzyklus verfolgt werden. Die regionale Beweglichkeit des Myokards wird als Vektor (grüne Pfeile) dargestellt. Anschließend werden die Werte für Geschwindigkeit, Displacement, Strain, Strain-Rate sowie die Time-to-Peak Analyse bestimmt.
- EKV-Bildgebung
-
-
EKV-Mode Imaging
Die so genannte Elektrokardiografie getaktete Kilohertz-Bildgebung (engl.: Electrocardiographic-gated Kilohertz –Visualization, EKV) dient der deutlichen Erhöhung der räumlichen und zeitlichen Auflösung in der Echokardiografie. Gerade in der präklinischen Forschung ist dies von großem Interesse, da bei Herzfrequenzen von Kleintieren um mehrere hundert Schläge pro Minute oft kleine Bewegungsanomalien des Herzmuskels auf Grund der physikalisch limitierten zeitlichen Auflösung im Ultraschall übersehen werden können.
Das Prinzip der EKV-Bildgebung überwindet dieses Problem, indem gleich eine Vielzahl von Herzschlägen hintereinander inklusive des EKG-Signals aufgenommen werden. Dieses Set aus Herzschlägen wird im Anschluss an die Aufnahmen durch eine Software an das EKG-Signal angeglichen. Dabei wird jedem Punkt eines EKG-Signals das entsprechende Ultraschall-B-Modus Bild aus allen Herzzyklusaufnahmen zugeordnet und zu einem einzigen Herzzyklus zusammengefasst. Die so erhaltene Aufnahme des Herzen spiegelt eine zeitliche Auflösung von mehreren hundert (bis zu tausend) Bildern pro Sekunde wider und ist bestens geeignet, entsprechend kleine Bewegungsanomalien ausfindig zu machen.
Konventionelle B-Mode Aufnahme eines linken Herzventrikels (drei Herzschläge mit Atmungsartefakt)
EKV-verbesserte Aufnahme desselben Herzen mit größerer Orts- und Zeitauflösung
Da die resultierende Bildinformation aus mehreren hundert Einzelbildern zusammengestellt wird, gelingt es mit Hilfe der EKV-Technik auch Aufnahmeartefakte zu reduzieren. Dies verbessert die räumliche Auflösung deutlich. Der visuelle Eindruck von Organstrukturen wie dem Myokard wird wesentlich verbessert, sodass auch Messungen im Ultraschallbild an Präzision gewinnen können. Bestimmungen der ventrikulären Wandstärken und Herzfunktionswerte profitieren von der EKV-Bildgebung.
EKV gestütztes Tracing eines linken murinen Herzventrikels in langer Achse
EKV gestütztes Tracing eines linken murinen Herzventrikels in kurzer Achse
Die entstehenden EKV-Ultraschallbilder sind für Publikationen und Präsentationen auf Grund ihrer höheren Auflösung besonders geeignet.
- 3D-Bildgebung
-
-
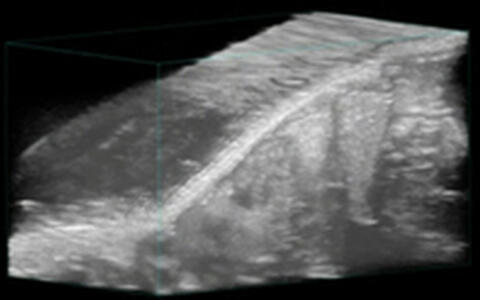
Mittels einer motorgestützten Halterung für die Ultraschallsonden ist es möglich, eine Reihe serieller Schnittaufnahmen durch ein ganzes Organ anzufertigen. Diese zweidimensionalen Schnittbilder können dann in einem computergestützten Verfahren in eine dreidimensionale Darstellung überführt werden. Dies bietet hervorragende Möglichkeiten, z.B. in Kombination mit dem Power-Doppler Modus die Gefäßdichte innerhalb eines Organs oder Tumors darzustellen und zu quantifizieren sowie volumetrische Bestimmungen vorzunehmen.
Im Folgenden werden zwei Beispiele gezeigt, wie die 3D-Bildegebung im Ultraschall genutzt werden kann, um einen subkutanen Tumor zu vermessen:
3D-Modelling für volumetrische Messungen
Mit den B-Modus Daten einer 3D-Aufnahme ist es einfach sich innerhalb der aufgenommenen Region zu orientieren und durch die verschiedenen Ebenen zu gehen. Dieses VIDEO zeigt die Aufnahme eines subkutanen Tumors, der so von allen Seiten betrachtet werden kann. Das Tumorgewebe kann deutlich vom umliegenden Gewebe abgegrenzt werden (rote Markierungslinie).
Durch Abgrenzung des Tumorgewebes in jeder Schichtaufnahme lässt sich im Anschluss eine dreidimensionale Kontur des Tumors rendern, um dessen Größe und Volumen zu bestimmen.
3D-Modelling serieller Power-Doppler Aufnahmen
Dieses VIDEO verdeutlicht die Vorteile einer 3D-Rekonstruktion serieller Power-Doppler Daten. Der durch die Power-Doppler-Technik erfasste Blutfluss in den Blutgefäßen wird rot dargestellt, das Gewebe außerhalb der Blutgefäße erscheint in den Graustufen des B-Modus. Durch die 3D-Rekonstruktion entsteht daraufhin eine sehr plastische Darstellung des Gefäßsystems.
Außerdem stehen verschiedene Werkzeuge zur Verfügung, um die Ansicht weiter anzupassen und die gewünschte Repräsentationsstärke zu erzielen.
Anfragen & Anmeldung
Um die Nutzung unserer Leistungen der in vivo Phänotypisierung anzumelden, verwenden Sie bitte dieses Anmeldeformular.
Aufträge für die in vitro Blutanalyse können über dieses Formular beantragt werden.
Bei weiteren Fragen kontaktieren Sie uns gern!