Multiphoton Intravital Mikroskopie
Prinzipien und Merkmale der Mehrphotonenmikroskopie
Die Multiphotonen (MP)-Laserscanningmikroskopie verwendet pulsierendes Licht, das von Titan-Saphir (Ti:sa)-Lasern emittiert wird, um Photonen zu kombinieren und die gleiche Anregung von Fluorophoren zu erreichen, die durch konventionelle Einzelphotonen-Laserscanningmikroskopie erzielt wird. Im Vergleich dazu weist die Mehrphotonenmikroskopie jedoch Eigenschaften auf, die sie für die intravitale Bildgebung besonders nützlich machen. Mit Anregungslicht längerer Wellenlänge, das weniger gestreut wird, kann die MP-Mikroskopie Gewebe um mehrere hundert µm tiefer durchdringen. Außerdem findet seine Anregung nur in einem begrenzten, punktförmigen Probenvolumen statt, wodurch die Fototoxizität und das Ausbleichen von Fluorophoren minimiert werden. Darüber hinaus ermöglicht das pulsierende Licht von Ti:sa-Lasern die Verwendung eines nichtlinearen optischen Prozesses, der als sogenannte Harmonic Generation (HG) bezeichnet wird, um nicht gelabelte Strukturen sichtbar zu machen, die von Molekülen mit spezifischen Konformationen, wie Kollagen und Myosin, gebildet werden. Andere ungelabelte Strukturen können auch auf der Grundlage der schwachen, aber identifizierbaren Fluoreszenz erkannt werden, die von verschiedenen Metaboliten emittiert wird, was manchmal die Abbildung ihrer relativen Häufigkeit und räumlichen Verteilung ermöglicht.
Beispiel für Strukturen, die in der MP-Mikroskopie ohne Markierung sichtbar sind: quergestreifte Muskeln in einer lebenden Maus.
Blau = Die Muskel-A-Bande ist sichtbar aufgrund des Harmonic Generation (HG)-Signals von Myosin.
Gelb = Organellen (I-Bande und perinukleärer Bereich), die durch endogene Fluoreszenz von Metaboliten markiert sind. Die unterschiedliche Intensität dieses Signals zwischen den drei Muskelfasern spiegelt ihren unterschiedlichen Metabolismus wider.
Anwendung in der intravitalen Bildgebung
Die Mehrphotonenmikroskopie kann Bilder mit einer maximalen 3D-Auflösung von etwa 1 µm aufnehmen, also nur geringfügig weniger als die in der konfokalen Einzelphotonenmikroskopie erreichte Auflösung. Unter Berücksichtigung ihrer anderen vorteilhaften Eigenschaften ist die MP-Mikroskopie daher optimal für die Abbildung lebender Organismen mit einer genügend hohen Auflösung, um einzelne Zellen und viele subzelluläre Strukturen zu erkennen. Ihre Anwendung in der intravitalen Bildgebung erlaubt es, im Laufe der Zeit mikroskopische Details vieler physio-pathologischer Prozesse zu verfolgen, die derzeit mit in-vitro-Modellen nicht reproduzierbar sind. Die wiederholte longitudinale Bildgebung ein und der selben Stelle ist je nach dem verwendeten spezifischen Bildgebungsmodell über Wochen oder sogar Monate hinweg möglich. Hierbei helfen Positionsverfolgungsmethoden, genau die selbe Stelle wieder zu finden, die über verschiedene Aufnahmezeitpunkte hinweg beobachtet werden soll. Im Vergleich zu histologischen Ex-vivo-Untersuchungen von Biopsien zu verschiedenen Zeitpunkten hat diese longitudinale Bildgebung den Vorteil, dass sie mit einer geringeren Anzahl von Tieren hoch signifikante Ergebnisse liefert.
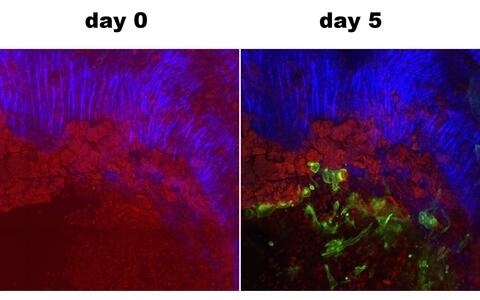
Longitudinale Bildgebung der Wundheilung im Knochen: Aufnahmen der gleichen Stelle innerhalb einer Mikroläsion (400 Mikrometer breit) im Scheitelknochen, jeweils 1 und 5 Tage nach dem Ereignis. Das Bild an Tag 5 zeigt die Invasion von Zellen (grün), die den Heilungsprozess einleiten werden. Knochengewebe ist aufgrund des HG-Signals von Kollagenfibrillen blau sichtbar.
Anforderungen und Einschränkungen
Das Erreichen eines hohen Niveaus an Bildschärfe in vivo ist mit einigen spezifischen Anforderungen und Einschränkungen verbunden, die bei der Entscheidung, ob diese Technik für Ihre Untersuchung geeignet ist, sorgfältig berücksichtigt werden müssen.
Zum Beispiel macht der beträchtliche Arbeitsaufwand, der für die Vorbereitung und Bildgebung jedes einzelnen Tieres erforderlich ist, diese Methode ungeeignet für breit angelegte Screening-Projekte, die auf die Untersuchung einer großen Anzahl von Tieren abzielen. Auch die hohe Vergrößerung und Auflösung, die erreicht werden, bringen ein ziemlich enges maximales Sichtfeld mit sich (ungefähr zwischen 0,5 x 0,5 und 1 x 1 mm, je nach verwendetem Objektiv). Die Abbildung größerer Bereiche ist zwar durch überlappende Aufnahmen möglich, aber ein solches Verfahren wäre äußerst zeitaufwendig.
Außerdem darf die zu visualisierende Probe nicht mehr als einige hundert µm vom Objektiv entfernt sein. Während diese Bedingung bei der Abbildung äußerer Organe (z.B. Haut) leicht erfüllt werden kann, erfordert die Visualisierung von Strukturen in einer tieferen Lage komplexere Lösungen, wie z.B. die Installation von Aufnahme-Sichtfenstern.
Darüber hinaus können aufgrund der hohen Vergrößerung selbst geringste Bewegungen betäubter Tiere Bildartefakte erzeugen. Daher ist es unerlässlich, spezielle Werkzeuge zu bauen, die in der Lage sind, den zu visualisierenden Teil sehr fest zu halten.
Wenn Ihre Untersuchung eine hochauflösende Abbildung von kleinen Gewebevolumina in einer geeigneten Anzahl von Tieren erfordert, kann die MP-Mikroskopie ein leistungsfähiges Werkzeug zur Durchführung dieser Aufgabe sein. Andernfalls, wenn Sie darauf abzielen, Gewebeteile von mehreren mm³ in einer größeren Anzahl von Tieren zu untersuchen (z.B. zur Überwachung der Größe von Tumoren), könnten Sie andere Methoden in Betracht ziehen, die eine geringere Auflösung, aber größere Bildvolumen bieten, wie z.B. Magnetresonanztomographie, Computertomographie und Hoch-Frequenz Ultraschall.
Modelle zur intravitalen Bildgebung
Neben der Wiedergabe der zu untersuchenden physio-pathologischen Bedingungen sollten die für die intravitale MP-Mikroskopie angepassten Bildgebungsmodelle auch die oben genannten zusätzlichen Anforderungen erfüllen. Darüber hinaus ist es natürlich wichtig, dass jede Art von Zellen oder Strukturen, die für die Untersuchung von zentraler Bedeutung sind, mit dieser Bildgebungstechnik sichtbar gemacht werden können. Aufgrund ihrer Eigenschaften kann die MP-Mikroskopie einige unmarkierte Strukturen mit Hilfe der Harmonic Generation (HG) oder der Fluoreszenz endogener Zellmetaboliten erkennen. Wenn jedoch bestimmte Zelltypen oder Strukturen nachgewiesen werden sollen, die diese Möglichkeit nicht bieten, muss deren Fluoreszenzmarkierung in das Modell implementiert werden. Dies ist möglich, indem sowohl genetische als auch chemische Werkzeuge eingesetzt werden, wie z.B. transgene Mäuse, die fluoreszierende Proteine und/oder injizierbare Fluoreszenztracer exprimieren.
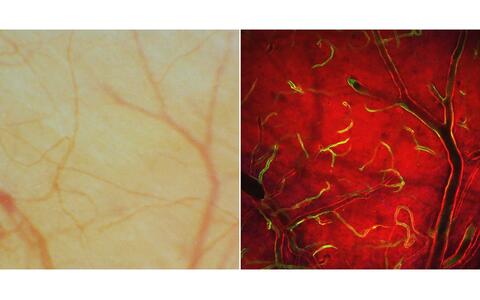
Verwendung eines Aufnahme-Sichtfensters in Kombination mit Fluoreszenzmarkierung spezifischer Zelltypen in einer transgenen Maus. MP-Intravitalbildgebung des Hirnrindenkortex in einer Maus mit fluoreszenzmarkierten Zellen (grün = Endothelzellen; rot: andere Zelltypen).
Unsere Serviceplattform bietet einsatzbereite und gut getestete Bildgebungsmodelle zur Darstellung verschiedener Organe und Gewebe (z.B. Haut, Knochen, Hirnrinde) und zur Untersuchung verschiedener Prozesse (z.B. Krebs, Wundheilung, Schlaganfall). Wenn möglich, werden wir neue Bildgebungsmodelle entwickeln, um dieses Repertoire zu bereichern und den spezifischen Bedürfnissen der Forschungsgruppen gerecht zu werden. Der Aufbau der notwendigen Instrumente und biologischen Hilfsmittel könnte jedoch einige Zeit in Anspruch nehmen. Aus diesem Grund empfehlen wir, zunächst zu prüfen, ob eines unserer bereits etablierten Modelle die durch Ihre Untersuchung aufgeworfenen Fragen beantworten kann. Sollte dies nicht der Fall sein, sind wir gerne bereit, die Durchführbarkeit eines neuen Modells zu erörtern und eine Schätzung der für seine Erstellung und Optimierung benötigten Zeit abzugeben.
Ex-vivo Bildgebung
Neben der in-vivo-Bildgebung lebender, betäubter Tiere ist die MP-Mikroskopie ein leistungsfähiges Werkzeug auch für die Analyse von ex-vivo fixierten oder frischen Gewebeproben. Die bessere Tiefenschärfe der Bildgebung ermöglicht die Darstellung dicker Proben mit intakten Organstrukturen und eliminiert Schnittartefakte, die bei Biopsien mit dünnen Schnitten auftreten. Wir haben Methoden zur Korrelation von In-vivo- und Ex-vivo-Aufnahmen etabliert, die es ermöglichen, in Biopsien genau dieselben Stellen wieder zu finden, die zuvor im lebenden Tier untersucht worden sind. Adäquate Permeabilisierungs- und Clearingmethoden ermöglichen es, solche Biopsien anzufärben und immunhistochemische Bilder zu erhalten, die mit den dynamischen Daten der intravitalen Bildgebung integriert werden können.
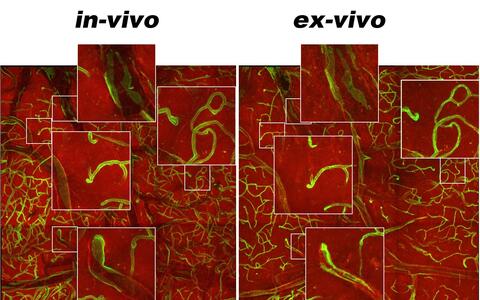
Korrelation der In-vivo- und Ex-vivo-Bildgebung des Hirnrindenkortex einer transgenen Maus, die grün und rot fluoreszierende Proteine in verschiedenen Zelltypen exprimiert (grün = Endothelzellen; rot: andere Zelltypen).
Beide Bilder wurden mit Hilfe der MP-Mikroskopie gewonnen, wobei die gleiche Stelle, die zuvor in vivo in einer Gewebebiopsie des ganzen Organs abgebildet wurde, wiedergefunden wurde. Vergrößerte Bilder zeigen, dass die detaillierte Gewebestruktur, die bei dünn geschnittenen Biopsien, die für normale konfokale Mikroskopie verwendet werden, oft verloren geht, auch in solchen dickeren Gewebebiopsien erhalten bleibt.
Wie wir helfen können
Das Leica SP8 Multiphotonen Mikroskop mit integrierter Ausstattung für die intravitale Mikroskopie
Wir bieten den Service eines hochmodernen Leica SP8 Dive Multiphotonenmikroskops, das mit der notwendigen Ausrüstung für die Abbildung lebender Mäuse und anderer Kleintiere ausgestattet ist. Das Mikroskop verfügt über zwei Ti:sa-Laser zur Multiphotonenanregung und einstellbare Emissionsfilter, die zusammen die gleichzeitige Anregung und getrennte Detektion der Signale von mehreren Fluorophoren ermöglichen. Ein Fluoreszenz-Lebensdauer-Imaging-Modul (FLIM) vervollständigt diesen Aufbau und ermöglicht die Unterscheidung selbst von Kanälen mit ähnlicher Farbe auf der Grundlage ihrer unterschiedlichen Fluoreszenz-Lebensdauer.
In unserer Zusammenarbeit mit der MDC-Transgentechnologie-Plattform haben wir fluoreszenzmarkierte transgene Mausstämme erzeugt, die speziell für diese Art der intravitalen Bildgebung entwickelt wurden, und viele andere sind von externen Quellen erhältlich. Wir stehen auch bei der Generierung anderer Hilfsmittel (z.B. Fluoreszenzreporter) und bei der Auswahl jedes anderen für Ihre Experimente notwendigen Materials (z.B. Kontrastmittel) zur Verfügung.