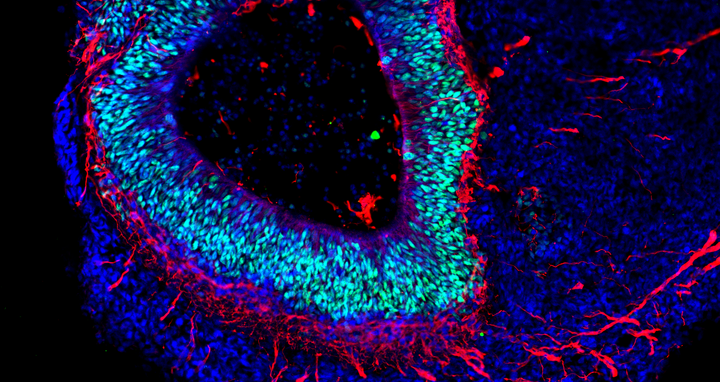
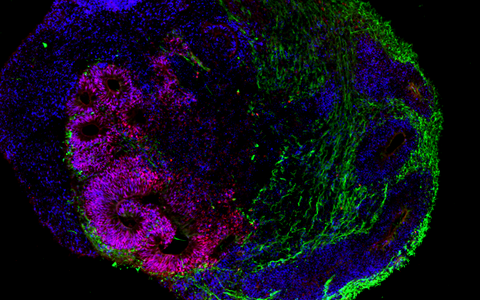
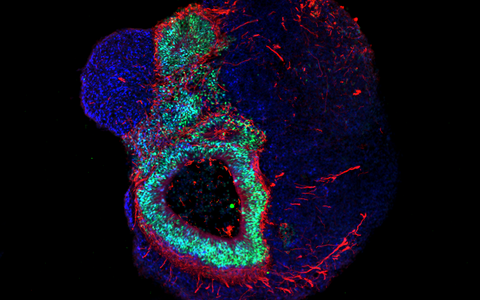
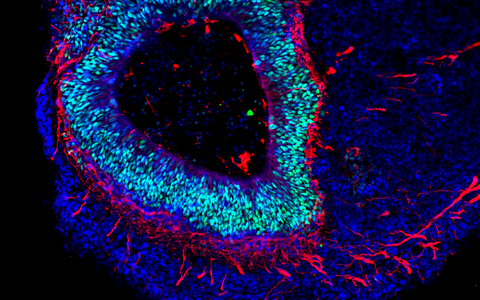
Das Gehirn im Labor
Das Faszinierende an Organoiden ist, dass es sich um komplexe humane Modellsysteme handelt.
Eine Nachbildung menschlicher Entwicklung und Krankheit in 3D: Das versprechen sich Forscher*innen von ihrer Arbeit mit Organoiden. Im Herbst 2019 hat das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) eine eigene Technologie-Plattform etabliert, um mit den im Labor gezüchteten Mini-Organen zunächst neuronale, später auch andere Krankheitsprozesse zu modellieren und in ihren räumlichen Interaktionen genauer zu verstehen. Die Plattform baut dabei auf einer umfangreichen Expertise am MDC zu Stammzellmethoden und Ansätzen der Genom-Editierung auf, ist am Standort Berlin-Mitte angesiedelt – und wird eng mit dem Labor von Professor Nikolaus Rajewsky und anderen Arbeitsgruppen am Berliner Institut für Medizinische Systembiologie zusammenarbeiten.
„Das Faszinierende an Organoiden ist, dass es sich um komplexe humane Modellsysteme handelt“, sagt Dr. Agnieszka Rybak-Wolf, die die neue Plattform leitet. „Organoide füllen damit eine Lücke zwischen in-vitro-Zellkulturen auf der einen Seite und lebenden Tiermodellen auf der anderen.“
Die Organoid-Technologie hat international wegen ihres Potenzials die Aufmerksamkeit zahlreicher Forschungsgruppen auf sich gezogen. Das Grundprinzip besteht darin, dass aus menschlichen Stammzellen und Vorläuferzellen (Progenitorzellen) organartige Strukturen im Labor rekonstruiert werden. Molekulare Signalsubstanzen steuern dabei die Differenzierung der Zellen in die verschiedenen Zelltypen und spezielle Kultursysteme begünstigen eine oft überraschend naturgetreue dreidimensionale Selbstorganisation. „Typischerweise sind Hirn-Organoide heute allerdings höchstens wenige Millimeter groß und erreichen ungefähr die Stufe von Organen während der 23. bis 28. Woche nach der Befruchtung“, sagt Rybak-Wolf. Gleichwohl sei es möglich, mit den 3D-Kulturen die zelluläre Zusammensetzung sowie viele funktionelle Eigenschaften verschiedenster Gewebetypen zu imitieren, etwa von Teilen des Gehirns, der Lunge, der Leber oder des Darms.
Die Technologie immer weiter verbessern
Wir hoffen, durch die 3D-Struktur der Organoide der Wirklichkeit sehr nah zu kommen.
„Wir hoffen, durch die 3D-Struktur der Organoide der Wirklichkeit sehr nah zu kommen“, kommentiert Dr. Sebastian Diecke, der die Technologie-Plattform für pluripotente Stammzellen am MDC leitet und dort die Methoden der Organoid-Forschung mit etabliert hat. Geplant ist, dass die Teams von Diecke und Rybak-Wolf, deren Ansätze sich ergänzen und teils überlappen, eng zusammenarbeiten und beide als Ansprechpartner zu Organoid-Technologien am MDC fungieren.
Rybak-Wolf konzentriert sich darauf, wie sich bei der Entwicklung von gesunden und kranken Organoiden das Transkriptom verändert, also die Übertragung genetischer Information von der DNA auf RNA. Ihre Arbeitsgruppe nutzt dazu moderne, hochauflösende Sequenziermethoden wie die Einzelzell-RNA-Sequenzierung, scRNA-seq. Der Ansatz verspricht, das zelluläre Zusammenspiel bei Entwicklungs- und Krankheitsprozessen besser zu verstehen. Außerdem will ihr Team die Organoid-Technologie so weiterentwickeln, dass komplexe und künstlich vaskularisierte Gehirn-Organoide über lange Zeitspannen im Labor reifen können.
Die Plattform von Diecke dagegen möchte beispielsweise die elektrische Signalverarbeitung in Gehirn-Organoiden untersuchen und die neuartigen 3D-Kulturen stabiler und reproduzierbarer machen. Zudem baut die Arbeitsgruppe ein Portfolio von pluripotenten Stammzelllinien mit definierten Eigenschaften für unterschiedlichste Forschungsprojekte auf. Das Team gewinnt die Stammzellen aus menschlichen Körperzellen, die sie reprogrammieren (induzierte pluripotente Stammzellen). Da man viele Erkrankungen nur mit genetisch veränderte Zelllinien erforschen kann, die etwa mit der Gen-Schere CRISPR-Cas genomisch editiert wurden, soll auch die Expertise der Transgenics-Plattform am MDC (geleitet von Dr. Ralf Kühn) in die Organoid-Projekte einfließen. Plattformübergreifende Vorhaben und Drittmittelanträge sind ebenfalls möglich.
Der Weg zu einer präziseren Medizin
Bereits jetzt untersucht die Plattform von Rybak-Wolf mithilfe der Mini-Gehirne beispielsweise das Leigh-Syndrom – eine erbliche, im Säuglingsalter einsetzende und meist tödliche Erkrankung des Gehirns, die man nicht mithilfe von Tierversuchen erforschen kann. Die Forschungsarbeiten erfolgen in Kooperation mit dem Labor von Professor Alessandro Prigione. Zusammen mit dem Neuropathologen Professor Frank Heppner von der Charité – Universitätsmedizin Berlin werden die Gehirn-Organoide dagegen genutzt, um früheste Veränderungen in den Hirnzellen bei der Alzheimer-Erkrankung zu entdecken und daraus neue Therapiemöglichkeiten abzuleiten. Gemeinsam mit der Arbeitsgruppe von Professor Markus Landthaler untersucht die Plattform, wie sich virale Infektionen auf die Hirnentwicklung von Embryonen auswirken. Auch die Ausbreitung von Hirntumoren will Rybak-Wolf mit Organoiden modellieren, um das Zusammenspiel von gesundem und erkranktem Gewebe besser zu verstehen. Darüber hinaus verwenden verschiedene andere Arbeitsgruppen am MDC Organoid-Modelle, beispielsweise um die Entwicklung der Niere zu erforschen (Professor Kai Schmidt-Ott) oder das neuromuskuläre System (Dr. Mina Gouti).
Große Bedeutung besitzt die Organoid-Plattform für das EU-weite Forschungsprojekt „LifeTime“, das von Nikolaus Rajewsky, Direktor des Berliner Instituts für Medizinische Systembiologie am MDC, gemeinsam mit Dr. Geneviève Almouzni vom Institut Curie in Paris koordiniert wird. LifeTime will das zeitliche und räumliche Zusammenspiel menschlicher Körperzellen und deren Veränderung bei Krankheitsprozessen analysieren – die dreidimensionalen Organoid-Kulturen sind dafür eine experimentelle Schlüsseltechnologie.
Langfristig könnten Organoide Tierversuche ergänzen oder zumindest teilweise überflüssig machen. So hofft man, dass man manche Auswirkungen genetischer Mutationen oder auch molekulare Medikamentenwirkungen wirklichkeitsgetreuer anhand der humanen 3D-Kulturen prüfen kann als an tierischen Modellorganismen. Eine Perspektive sind dabei personalisierte Medikamententests: Wie Pilotstudien gezeigt haben, können aus den Körperzellen von Patient*innen krankheitsspezifische Organoide hergestellt und daran Arzneimittel auf ihre Wirksamkeit untersucht werden. Ein unmittelbarer Beitrag zu einer individualisierten, präziseren Medizin.
Text: Martin Lindner
Weiterführende Informationen