Die Gewebemacherin
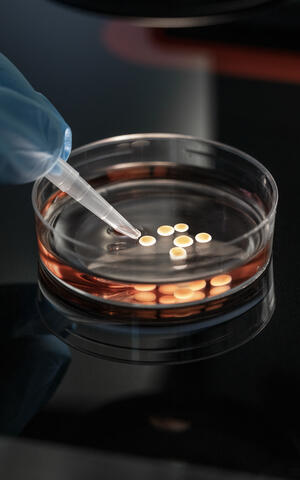
Dr. Mina Gouti wiegt die Petrischale in der Hand, dass die kleinen weißen Kügelchen in der rosafarbenen Flüssigkeit umherschwappen. Sie schaut sie fürsorglich an. Vor einem Monat hat ihre Mitarbeiterin die Organoide zum Leben erweckt, seither sind sie auf gut einen Millimeter angewachsen. „Am Anfang bekommen sie jeden Tag Nährstoffe, damit sie zufrieden sind, später alle zwei oder drei Tage“, sagt Gouti und legt die Schale mit den Organoiden behutsam zurück in den Brutkasten, der die Temperatur bei behaglichen 37 Grad hält, wie im menschlichen Körper. „Wenn wir gut auf sie Acht geben, können sie sechs Millimeter groß werden und bis zu zwei Jahre alt.“
Bis zu zwei Jahre alt können die Organoide in der Petrischale werden.
Die Organoide, die Gouti im Labor erschafft, sind organähnliche Gewebestrukturen, die aus Nervenzellen des Rückenmarks und assoziierten Muskelzellen bestehen. Betrachtet man sie durch ein Mikroskop, lassen sie sich eindeutig unterscheiden: der dunkle Muskelkern und das hellere umgebende Nervengewebe. Die winzigen Muskelpakete zucken rhythmisch. „Sie kontrahieren wie Muskeln im menschlichen Körper“, sagt Gouti, die am Max-Delbrück-Centrum für Molekulare Medizin (MDC) die Arbeitsgruppe „Stammzell-Modellierung der Entwicklung und Erkrankung“ leitet. Ihre Begeisterung wirkt mitreißend. „Das ist faszinierend, weil es zeigt, dass wir funktionales Gewebe erzeugt haben.“
Sie entwickelt die Organoide aus umprogrammierten Stammzellen von Patient*innen, die an neuromuskulären Erkrankungen wie spinaler Muskelatrophie (SMA) leiden. Die tödliche Erkrankung lässt die für die Bewegung verantwortlichen Motoneuronen absterben. „Die Kinder bekommen während der ersten Lebensmonate Lähmungen, am Ende können sie nicht einmal atmen“, sagt Gouti. „Mit Hilfe der Organoide wollen wir verstehen, warum genau die Motoneuronen absterben und Wege finden, das aufzuhalten“, sagt Gouti. Auch für andere bislang unheilbare neuromuskuläre Erkrankungen, etwa Amyotrophe Lateralsklerose, die Erwachsene betrifft, setzt Gouti auf Organoide.
„Ich habe mich in die Stammzellen verliebt“
Mina Gouti ist Entwicklungsbiologin. Schon früh hat sie interessiert, wie der menschliche Körper zu dem wird, was er ist: „In der Schule habe ich so viele Fragen gestellt, dass mein Biologielehrer mir empfahl, Wissenschaftlerin zu werden und sie mir alle selbst zu beantworten.“ Sie verließ ihre Heimatstadt Athen, studierte Molekularbiologie in London. Im Labor sah sie, wie die Postdocs an Zellkulturen mit embryonalen Stammzellen von Mäusen forschten. „Sie schirmten sie anfangs vor mir ab“, erinnert sich Gouti. „Als ich doch mit ihnen arbeiten durfte, war ich total aufgeregt und habe mich sofort in die Stammzellen verliebt, weil sie dieses unbegrenzte Potenzial haben. Man muss lernen, sie zu kontrollieren, wenn man etwas von ihnen will.“
Das Pre-GoBio-Programm des MDC fördert Goutis Idee, Bioreaktoren für die Erzeugung von Organoiden in größerem Maßstab einzusetzen. Darin wachsen bis zu 200 der weißen Kügelchen auf einmal in Nährflüssigkeit und können älter als in den Petrischalen werden.
Sie eignete sich all die nötigen Techniken an und untersuchte für ihre Doktorarbeit, welche Signalwege Stammzellen dazu bringen, die Zelltypen des Zentralen Nervensystems auszubilden. Erst zwei Jahre zuvor hatte der Japaner Shin’ya Yamanaka die ersten induzierten pluripotenten Stammzellen (iPSC) hergestellt und damit die Zellentwicklung umkehrbar gemacht: Auf einmal war es möglich, eine Hautzelle zur Stammzelle umzuprogrammieren und aus dieser wiederum jede andere Zelle des Körpers zu erschaffen.
Nun generierte Gouti Nervenzellen des Gehirns und der Halswirbelsäule aus pluripotenten Stammzellen. Doch sie scheiterte an den Neuronen des unteren Rückenmarks. Am Francis Crick Institute in London wurde sie auf neuromesodermale Vorläuferzellen (NMPs) aufmerksam, eine flüchtige Zellpopulation, die 1884 entdeckt worden war und sowohl Nerven- als auch Muskelzellen ausbilden kann. Waren sie die entscheidende Vorstufe für alle anderen Zellen des Rückenmarks? Im Mai 2013 gelang es ihr, die ersten NMPs aus pluripotenten Stammzellen im Labor herzustellen, die dazu fähig waren, auch die Neuronen des unteren Rückenmarks und die damit verbundene Skelettmuskulatur auszubilden.
Drei Überraschungen
Am MDC, wo sie 2016 als Juniorgruppenleiterin anfing, setzte Gouti alles auf die NMP-Karte. Zurecht, wie sich bald herausstellte. Ihr Labor konzentrierte sich darauf, aus pluripotenten Stammzellen NMPs zu erschaffen, die denen im menschlichen Körper ähneln. „Kurz darauf hatte ich die gewagte Idee, sie zu neuromuskulären Organoiden heranwachsen zu lassen und zu schauen, ob sie tatsächlich beide Zelltypen ausbilden würden, Nervenzellen und Muskelzellen in 3D, wie im menschlichen Körper“, sagt Gouti. Das war niemandem zuvor gelungen.
Das sind die Momente, für die man als Wissenschaftlerin lebt – etwas zu sehen, was man überhaupt nicht erwartet hat, das aber zu 100 Prozent Sinn macht.
Sie sorgte für die perfekte Umgebung, gab die NMP-Zellen mit Nährlösung in die Vertiefungen einer nichthaftenden Mikrotiterplatte und beobachtete, wie kleine, intakte Kügelchen entstanden. „Nach fünf Tagen sahen wir durchs Mikroskop, dass sich tatsächlich beide Gewebetypen herausbildeten.“ Es war die erste von drei Überraschungen. Die 3D-Kulturen waren so robust, dass sie für einen Monat und länger am Leben blieben. An Tag 40 bemerkten Gouti und ihr Doktorand Jorge Martins, dass die Organoide kontrahierten. Die Motoneuronen streckten also ihre Axone zu den Muskelzellen aus und brachten sie über eine Synapse, die neuromuskuläre Endplatte, dazu, sich zu bewegen. Rückenmark und Muskulatur tauschten Signale aus. Eine Sensation.
Sie entdeckten auch, dass sich in den neuromuskulären Organoiden (NMOs) Schwannzellen und ein erweitertes Netzwerk von Nervenzellen gebildet hatten, das die Funktion der Zentralen Mustergeneratoren-Schaltungen (ZMG) übernahm, also rhythmische Signale aussendete, wie sie beispielsweise für das Atmen und Gehen entscheidend sind. Eine weitere Sensation. Ihr viel beachtetes Paper erschien 2020 in „Cell Stem Cell“. „Erstmals konnten wir ein solch komplexes Netzwerk in einem menschlichen Modell beobachten“, sagt Gouti. „Das sind die Momente, für die man als Wissenschaftlerin lebt – etwas zu sehen, was man überhaupt nicht erwartet hat, das aber zu 100 Prozent Sinn macht.“
Wie können Organoide älter werden?
Die Erfolge bestätigten ihre Hoffnung, dass NMOs bei der Suche nach gezielten und rechtzeitigen Therapien für neuromuskuläre Erkrankungen helfen können. Sie will nun positionsspezifische Organoide kultivieren, die bestimmten Rückenmarkssegmenten und ihren zugehörigen Muskeln entsprechen. Und diese dazu zu bringen, Blutgefäße auszubilden, damit sie größer und älter werden und so dem Gewebe von Erwachsenen stärker ähneln. „Dann könnten wir nachvollziehen, wann genau sich eine Erwachsenenkrankheit wie Amyotrophe Lateralsklerose wo genau im Gewebe entsteht und ob andere Zelltypen betroffen sind, bevor die Motoneuronen absterben und die Lähmung einsetzt“, sagt Gouti. „Wir könnten versuchen diese Zellen zu retten, bevor es zu spät ist.“ Auch für die Erforschung neurodegenerativer Erkrankungen eröffnen die NMOs neue Möglichkeiten.
Mina Gouti an einer sterilen Werkbank. Mithilfe einer Pipette tauscht sie die Nährflüssigkeit für die Organoide aus.
Goutis langfristiges Ziel ist es, alle Zelltypen des Zentralen Nervensystem aus Stammzellen zu erschaffen und ein Organoid zu entwickeln, dass neuronale Signale vom Gehirn durch das gesamte Rückenmark bis zu den Muskeln verarbeiten kann. Sie möchte beobachten, wo und wie die Kommunikation falsch läuft, wenn Menschen erkranken. Für diese neuen Wagnisse hat sie 2020 einen Consolidator Grant des Europäischen Forschungsrats (ERC) erhalten.
„Organoide helfen uns auch dabei, die Zahl der Tierversuche auf dem Weg zu klinischen Studien zu reduzieren“, sagt Gouti. „Ganz abschaffen können wir sie leider nicht. Wir brauchen komplexere Modelle, die dem Organismus näherkommen.“
Wahre Kunstwerke eingefärbter Neuronen und Muskelzellen
Ein Stockwerk über dem Organoid-Labor richtet ihr Team an diesem Nachmittag ein Hochdurchsatz-Bildgebungssystem ein. Ein Roboterarm pipettiert Hunderte verschiedene Medikamente und testet an patientenspezifischen Organoiden, ob sie wirksam zur Behandlung von spinaler Muskelatrophie sind. Gerade erscheinen die ersten Aufnahmen auf dem Bildschirm. Es sind wahre Kunstwerke eingefärbter Muskelzellen, Neuronen mit langen Axonen – Explosionen aus grünen, gelben, roten und blauen Mikrostrukturen. „Was für eine Auflösung!“, schwärmt Gouti. Sie kann es kaum abwarten, die neuen Möglichkeiten der Technik voll auszuschöpfen.
Bei aller Begeisterung für die Funktion von Motoneuronen, Stammzellen und Organoiden, liebt Gouti auch deren Schönheit. In Griechenland hat sie ein Buch mit Bildern ihrer Laborarbeit herausgegeben und sie in zwei Ausstellungen präsentiert. Sie will die Stammzellforschung der Öffentlichkeit näherbringen. Zu jeder Aufnahme hat sie Schriftsteller*innen und ein krebskrankes Kind befragt. „In den rot eingefärbten Astrozyten, die aus Stammzellen entstanden sind, sah der Schriftsteller tanzende Zellen, das Mädchen einen Tunnel, von dem es nicht wusste, wohin er führt“, sagt Gouti. „Ich würde mir sehr wünschen, dass wir mit den Organoiden Wege finden, um Menschen mit tödlichen neuromuskulären Krankheiten besser zu helfen.“
Text: Mirco Lomoth