Reparatur-Stopp im Tumor
Es ist eine der häufigen Krebsdiagnosen in der Kindheit und Jugend – und eine besonders schlimme dazu. Denn die Therapie des Rhabdomyosarkoms, einer bösartigen Erkrankung der Skelettmuskulatur, ist seit Jahrzehnten nahezu unverändert und bislang nur wenig erfolgreich. „Von den jungen Menschen mit der besonders schweren Form, dem alveolären Rhabdomyosarkom, leben fünf Jahre nach der Diagnose nur noch etwa 30 Prozent“, sagt Heathcliff Dorado García.
Der junge Spanier forscht in Professor Anton Henssens Arbeitsgruppe „Genomische Instabilität bei kindlichen Tumoren“ am Experimental and Clinical Research Center (ECRC), einer gemeinsamen Einrichtung der Charité – Universitätsmedizin Berlin und des Berliner Max Delbrück Centers. Zusammen mit Henssen hat Dorado García es sich zur Aufgabe gemacht, endlich eine neue und bessere Behandlungsstrategie für das Rhabdomyosarkom zu entwickeln.
Elimusertib ist hochwirksam in Mäusen und wird bereits in ersten klinischen Studien eingesetzt. Jetzt hoffen wir darauf, schon sehr bald ähnlich gute Effekte bei Kindern und Jugendlichen zu erzielen.
Der Tumor verschwand komplett
Im Fachblatt „Nature Communications“ haben die beiden Krebsforscher gemeinsam mit weiteren Kolleg*innen aus Berlin und des Memorial Sloan Kettering Cancer Center in New York jetzt wichtige Erfolge vermelden können. „Mit den von uns verwendeten Wirkstoffen, unter anderem Elimusertib, ist es uns gelungen, ein alveoläres Rhabdomyosarkom in Mäusen vollständig verschwinden zu lassen“, sagt der Erstautor der Studie, Dorado García. Das Team hatte das Mausmodell aus dem Tumor einer Patientin entwickelt, bei der die gängige Chemotherapie nicht angeschlagen hatte. Somit wiesen die Tumore der Mäuse die gleichen molekularen Besonderheiten auf wie der Krebs der erkrankten Jugendlichen.
„Elimusertib ist hochwirksam in Mäusen und wird bereits in ersten klinischen Studien eingesetzt. Jetzt hoffen wir darauf, schon sehr bald ähnlich gute Effekte bei Kindern und Jugendlichen zu erzielen“, sagt Letztautor Henssen, der nicht nur Wissenschaftler ist: Als Kinderarzt an der Klinik für Pädiatrie mit Schwerpunkt Onkologie und Hämatologie der Charité kümmert er sich persönlich um die jungen Krebspatient*innen.
Die Zahl der Chromosomen veränderte sich
Der Wirkstoff Elimusertib, den das Pharmaunternehmen Bayer am Standort Berlin entwickelt hat, zählt zu den ATR-Hemmern, die in der Krebstherapie seit einiger Zeit zum Einsatz kommen. In kindlichen Zellen sind sie – bisher allerdings fast ausschließlich in vitro – unter anderem beim Ewing-Sarkom, das meist die Knochen befällt, beim Neuroblastom und bei einigen Leukämien erprobt worden. Entartete Zellen haben meist viele kleine Schäden in ihrem Erbgut. Das nutzen die Medikamente aus: „ATR-Hemmer blockieren ein Enzym, das an der Reparatur der DNA-Defekte maßgeblich beteiligt ist“, erläutert Dorado García. „Dadurch sammeln sich die Schäden an, bis die Zelle irgendwann nicht mehr lebensfähig ist und den programmierten Zelltod einleitet – also quasi Selbstmord begeht.“
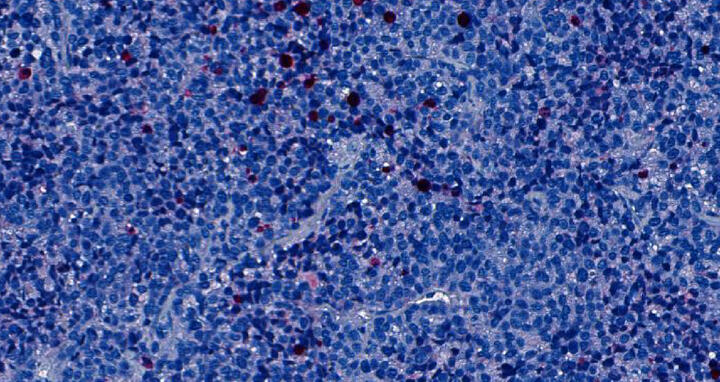
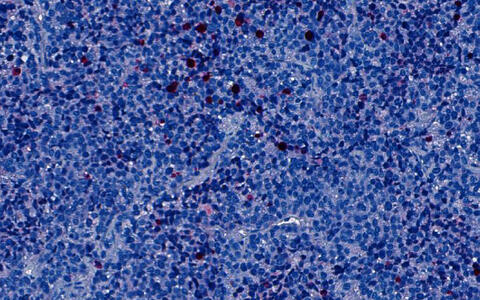
Die Tumorzellen eines Patienten mit Alveolarem Rhabdomyosarkom wurden einer Maus implantiert. Nachdem die Maus zwei Wochen mit einem ATR-Hemmer behandelt worden war, wurden die Zellen in Rot / Pink angefärbt, die abgestorben waren
Als besonders empfindlich haben sich in den Experimenten Krebszellen erwiesen, die ein fusioniertes Protein namens PAX3-FOXO1 herstellen. Fusionsproteine entstehen durch die gemeinsame Expression zweier Gene, die hintereinander auf dem Erbgutstrang liegen. „Diese Krebszellen wurden durch die Behandlung mit ATR-Inhibitoren aneuploid – das heißt, die Anzahl ihrer Chromosomen veränderte sich“, erklärt Dorado García. Das habe den Suizid der Zellen, die Apoptose, ausgelöst. „Zudem konnten wir zeigen, dass PAX3-FOXO1 selbst eine erhöhte Zahl von DNA-Schäden in den Zellen verursacht“, sagt der Forscher. „Das macht Zellen mit diesem Protein zwar besonders gefährlich, aber sie reagieren auf eine Störung der DNA-Reparatur auch sensibler als andere.“
Auch Kombinationstherapien sind denkbar
Darüber hinaus hat der Doktorand bereits nach den Ursachen für mögliche Resistenzen gegen die Wirkstoffgruppe gesucht. Gefunden hat er sie in den Genen der sogenannten FOS-Familie. „FOS-Proteine sind Transkriptionsfaktoren, die das Ablesen anderer Gene steuern“, erklärt der Forscher. „Eine Überexpression der FOS-Gene führt dazu, dass die Tumorzellen auf Elimusertib und andere ATR-Hemmer nicht mehr gut ansprechen.“ Noch habe man den Mechanismus dahinter zwar nicht im Detail verstanden, weitere Studien seien aber geplant, sagt Dorado García.
Zudem prüfen er und Henssen derzeit Kombinationsbehandlungen, um die Wirksamkeit der Therapie zu verlängern – etwa mit dem PARP-Inhibitor Olaparib. Dieser Wirkstoff ist unter anderem bereits gegen Brust- und Eierstockkrebs zugelassen und behindert über einen anderen Mechanismus die DNA-Reparatur der Tumorzellen. Man werde hierzu in Kürze eine ganze Reihe weiterer präklinischer Daten liefern, verspricht Henssen.
Erste klinische Untersuchungen laufen
„Auf Grundlage unserer Ergebnisse wurde in den USA im Dezember 2021 eine Studie mit Kindern und Jugendlichen gestartet, um die Sicherheit und die optimale Dosis von Elimusertib zu ermitteln“, berichtet der Onkologe. Geprüft werde der Wirkstoff sowohl für das alveoläre Rhabdomyosarkom als auch für eine Reihe weiterer kindlicher Krebsarten, die auf die Standardtherapie entweder nicht angesprochen haben oder aber zurückgekehrt sind. Initiiert wurde die Studie von Dr. Michael Ortiz vom Memorial Sloan Kettering Cancer Center, der an der aktuellen Veröffentlichung ebenfalls beteiligt gewesen ist.
Auch in Berlin werden klinische Studien – insbesondere zu Kombinationstherapien –vorbereitet, etwa von Dr. Monika Scheer, einer Sarkom-Expertin an der Charité. „Und schließlich möchten wir in nächster Zeit noch weitere Faktoren ermitteln, die kindliche Tumore für ATR-Hemmer und vergleichbare Wirkstoffe empfindlicher machen“, kündigt Henssen an. Er habe die Hoffnung, dass Medikamente, die die Reparatur von DNA-Schäden in entarteten Zellen behindern, auch solchen Kindern helfen könnten, die an anderen schwer heilbaren und noch häufigeren Krebsarten leiden.
Text: Anke Brodmerkel
Weiterführende Informationen
Literatur
Heathcliff Dorado García et al (2022): „Therapeutic targeting of ATR in alveolar rhabdomyosarcoma“. Nature Communications, DOI: s41467-022-32023-7