Schlechter Lieferservice im Gehirn
Dr. Melissa Birol leitet die AG "Molekulare Biophysik in der quantitativen Neurowissenschaft".
Wie Alzheimer entsteht, ist noch immer unbekannt. Man weiß, dass im Gehirn die Nervenzellen reihenweise untergehen. Man weiß auch, dass sich zwischen den Zellen Plaques ablagern, unlösliche Eiweißklumpen aus einem Protein namens Beta-Amyloid. Bekannt ist zudem, dass im Inneren der Zellen faserige Tau-Fibrillen zu finden sind. Bei Alzheimer-Patient*innen ist es chemisch so verändert, dass es Eiweißfasern bildet, die den Tod der Zellen zur Folge haben.
Nichts kann das Sterben der Neuronen aufhalten
Und schließlich kennt man noch eine genetische Ursache für ein erhöhtes Risiko der Altersdemenz: Menschen mit einer bestimmten Variante des Apolipoproteins E, ApoE 4 genannt, sind deutlich gefährdeter als andere, die entweder ApoE 3 oder das seltenere ApoE 2 aufweisen. ApoE ist eine Art Lieferservice im Gehirn. Es versorgt die Nervenzellen unter anderem mit Fettsäuren, die ihre Synapsen brauchen, um richtig zu funktionieren.
All dieses Wissen hat bislang allerdings nicht dazu geführt, die Anfänge von Alzheimer zu verstehen. Wirksame Therapien hat es erst recht nicht hervorgebracht, auch wenn bereits alle drei Proteine, Beta-Amyloid, Tau und ApoE, Ziele von neuen und von vielen Hoffnungen begleiteten Wirkstoffen gewesen sind. Bislang kann nichts das Sterben der Neuronen aufhalten.
Zu wenig Fett für die Synapsen
Erhalten die Nervenzellen zu wenig Lipide, stört das vor allem auch die Funktion ihrer Synapsen.
Dr. Melissa Birol, die Leiterin der Arbeitsgruppe „Single Molecule Biophysics probing Quantitative Neuroscience“ (Einzelmolekül-Biophysik zur Untersuchung der quantitativen Neurowissenschaften) am Berliner Institut für Medizinische Systembiologie des Max Delbrück Centers (MDC-BIMSB) verfolgt nun einen neuen Ansatz. Dieser klingt für Expert*innen so vielversprechend, dass die US-amerikanische Alzheimer's Association Birols Vorhaben jetzt drei Jahre lang mit insgesamt rund 150.000 US-Dollar unterstützt. Die Alzheimer's Association ist die weltgrößte gemeinnützige Gesundheitsorganisation, die sich für die Erforschung von Alzheimer sowie für die Pflege und Unterstützung der Betroffenen einsetzt.
„Wir vermuten, dass Tau und ApoE 4 sich aus irgendeinem Grund zusammentun und gemeinsam den Fetttransport sowohl zwischen den Astrozyten und den Neuronen als auch innerhalb der Nervenzellen stören“, sagt Birol. Astrozyten sind sternförmige Zellen, die die Neuronen als Nähr- und Stützzellen umgeben. „Erhalten die Nervenzellen zu wenig Lipide, stört das vor allem auch die Funktion ihrer Synapsen“, erläutert die Biophysikerin. „Dadurch können die Neuronen nicht mehr miteinander kommunizieren. Es wird eine Kaskade zellulärer Ereignisse angestoßen, die im Tod der Neuronen enden.“
Gestörter Transport in den Zellen
Auf dieses womöglich sehr unheilvolle Zusammenspiel von Tau und ApoE sind Birol und ihr Team in Experimenten mit Hirnorganoiden, im Labor gezüchteten Mini-Organen, gestoßen. „Wir konnten beobachten, dass sich die beiden Proteine bereits außerhalb der Nervenzellen aneinander anlagern“, berichtet die Forscherin. „Innerhalb der Zellen fanden wir sie gemeinsam in winzigen Fetttröpfchen, die sich – je nach ApoE-Variante – mit unterschiedlicher Geschwindigkeit und unterschiedlichen Mustern folgend in den Zellen ausbreiteten.“ Fetttröpfchen mit ApoE 4 und Tau seien anfangs, anders als solche mit ApoE 3, innerhalb der Zelle weitgehend beweglich gewesen. Mit der Zeit nehme die Dynamik der Tröpfchen ab, sie altern möglicherweise. Das korreliere mit dem Aufbau von Fettspeichereinheiten, auch Fetttröpfchen genannt.
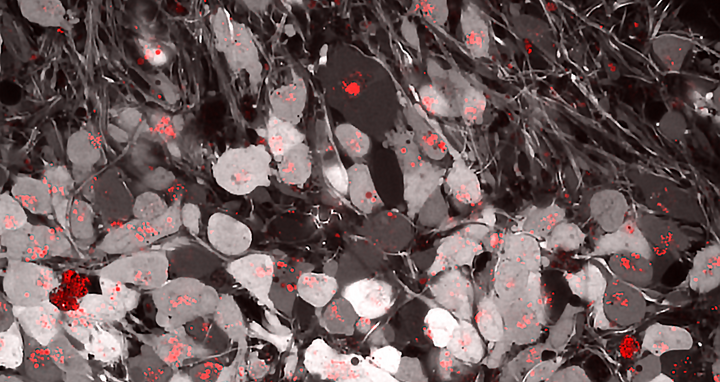
Anreicherung des Alzheimer-assoziierten Proteins Tau in einem menschlichen Gehirn-Organoid: Graue Markierungen dokumentieren die Gesundheit der Neuronen, rot zu sehen sind Tau-Ansammlungen in den Zellkörpern
„Unser Ziel ist es nun, die biophysikalischen Vorgänge zu verstehen, die das Zusammenwachsen dieser Proteingebilde aus ApoE und Tau in einzelnen Zellen und in den Organoiden ermöglichen“, sagt Birol. Dazu wollen die Forschenden modernste Methoden der Einzelmolekülspektroskopie und der Elektronenmikroskopie miteinander kombinieren. Zudem werden sie das Lipidprofil der Zellen ermitteln und mithilfe der funktionellen Kalzium-Bildgebung prüfen, inwieweit das Zusammenspiel von ApoE 4 und Tau in den Lipidtröpfchen den Fettstoffwechsel der Gehirnzellen verändert, den Fetttransport stört und dadurch die Funktionen der Nervenzellen und ihrer Synapsen beeinträchtigt.
Neue Ansätze für wirksamere Therapien
„Indem wir die molekularen Grundlagen einer sich entwickelnden Alzheimer-Krankheit besser verstehen, wird es uns hoffentlich gelingen, Ansätze für neue therapeutische Strategien aufzuzeigen, die die toxischen Lipid-Protein-Ansammlungen im Visier haben“, sagt Birol. Vielleicht lässt sich dann das Massensterben der Neuronen endlich aufhalten.
Text: Anke Brodmerkel