Potenzieller Alzheimer-Marker entdeckt
Die Alzheimer-Demenz gilt als Erkrankung des Alters. Meist sind Betroffene jenseits der 65, wenn sie die Diagnose erhalten. Doch bereits viele Jahre bevor sich Symptome einer Demenz zeigen, entsteht die Krankheit im Verborgenen: Kleine Proteine, sogenannte Beta-Amyloid-Peptide, verklumpen im Gehirn zu Plaques, was zu Entzündungen und letztlich zum Tod von Nervenzellen führt.
Zusammenspiel der Proteine im Gehirn entlarvt Krankheitsmechanismus
Es fehlen gute diagnostische Marker, um die beginnende Krankheit frühzeitig und sicher zu erkennen oder Vorhersagen über ihren Verlauf zu machen.
Wie es zu den krankhaften Veränderungen im Gehirn kommt, ist im Detail noch unklar. „Es fehlen gute diagnostische Marker, um die beginnende Krankheit frühzeitig und sicher zu erkennen oder Vorhersagen über ihren Verlauf zu machen“, sagt Professor Erich Wanker, Leiter der Arbeitsgruppe „Proteomforschung und molekulare Mechanismen bei neurodegenerativen Erkrankungen“ am Max Delbrück Center. Wanker untersucht mit seinem Team das Proteom im Alzheimer-Gehirn – das Zusammenspiel aller Proteine, die daran beteiligt sind, dass die Krankheit entsteht und voranschreitet. Jetzt beschreiben sie im Journal „Genome Medicine“ einen neuen Mitspieler im Krankheitsgeschehen: Er kann zur Aufklärung des Krankheitsmechanismus beitragen und hat das Potential zum Marker für eine bessere Diagnostik.
Um die Veränderungen des Proteoms zu analysieren, arbeitet Wankers Team mit genetisch veränderten Mäusen. Die Tiere tragen in ihrem Erbgut fünf verschiedene Mutationen, die man von Betroffenen mit einer genetisch bedingten Alzheimer-Variante kennt. In den Gehirnen der Nager entstehen die typischen Beta-Amyloid-Plaques, und sie zeigen Symptome wie Demenz.
Neue Perspektiven für das Krankheitsverständnis
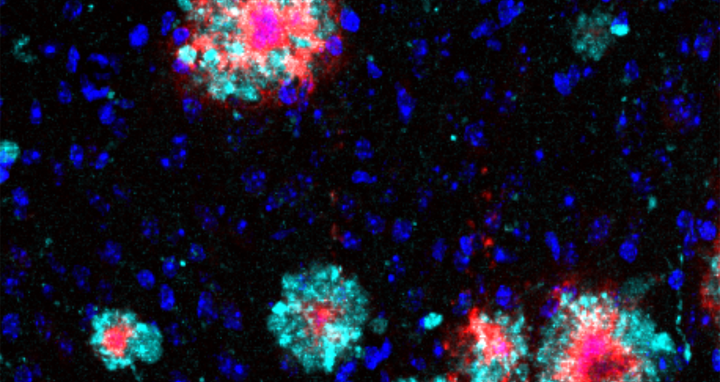
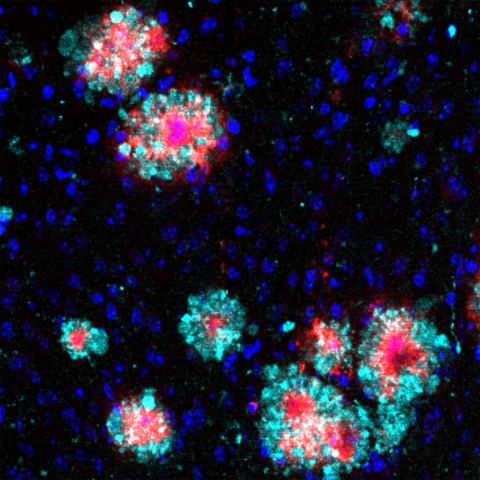
Gehirnschnitt einer Alzheimer-Maus: Das Protein Arl8b (türkis) zeigt eine Anhäufung um die Amyloid-b-Aggregate (rot). Zellkerne sind blau angefärbt. Der Schnitt wurde mit Immunofluoreszenz analysiert.
„Bei unseren Analysen ist uns ein Protein mit der Bezeichnung Arl8b aufgefallen, das sich zusammen mit den Beta-Amyloid-Plaques im Gehirn der Tiere anreichert“, sagt Annett Böddrich, Erstautorin der Veröffentlichung. Auch in Gehirnproben von Alzheimer-Patienten fanden die Forschenden Ansammlungen des Proteins.
Arl8b ist mit Lysosomen verbunden, Zellorganellen, die eine Rolle beim Abbau von zusammengeklumpten Proteinen spielen. Erst kürzlich haben andere Forschende beim Fadenwurm C. elegans etwas Interessantes entdeckt: Wenn man die Produktion von Arl8b erhöht, kann dies dazu führen, dass Beta-Amyloid-Aggregate abgebaut werden und die schädliche Wirkung auf Nervenzellen sinkt. Eine genauere Untersuchung von Arl8b könnte entscheidend sein, um das Krankheitsgeschehen bei Alzheimer besser zu verstehen – und möglicherweise sogar einen neuen Angriffspunkt für Therapien aufzeigen.
Interessanter Kandidat als Marker für die Diagnostik
Doch das ist noch nicht alles: „Wir können nachweisen, dass Arl8b im Liquor, also in der Gehirnflüssigkeit von Alzheimer-Patienten gegenüber gesunden Kontrollpersonen signifikant erhöht ist“, sagt Böddrich. Liquor ist im Gegensatz zu Hirngewebe für diagnostische Untersuchungen gut zugänglich. „Das macht Arl8b zu einem interessanten Kandidaten für einen diagnostischen Marker“, sagt Böddrich.
Es wurde allerdings erst eine kleine Gruppe von Alzheimer-Patienten untersucht. „Für konkrete Hoffnung auf einen diagnostischen Test ist es zu früh“, dämpft Wanker die Erwartungen. Doch er ist überzeugt: „Unsere Arbeit zeigt, dass Proteomforschung entscheidende Informationen liefert, um Krankheitsmechanismen und Marker zu identifizieren, und so die Forschung voranzutreiben – nicht nur bei der Alzheimer-Krankheit, sondern auch bei anderen komplexen neurodegenerativen Erkrankungen wie Parkinson oder Chorea Huntington.“
Text: Stefanie Reinberger
Weiterführende Informationen
Literatur
Annett Boeddrich et al. (2023): “A proteomics analysis of 5xFAD mouse brain regions reveals the lysosome associated protein Arl8b as a candidate biomarker for Alzheimer’s disease,” Genome Medicine, DOI: 10.1186/s13073-023-01206-2
Downloads
Gehirnschnitt einer Alzheimer-Maus: Das Protein Arl8b (türkis) zeigt eine Anhäufung um die Amyloid-b-Aggregate (rot). Zellkerne sind blau angefärbt. Der Schnitt wurde mit Immunofluoreszenz analysiert. Bild: AG Wanker, Max Delbrück Center
Pressekontakte
Professor Erich E. Wanker
Gruppenleiter “Proteomforschung und molekulare Mechanismen bei neurodegenerativen Erkrankungen”
Max Delbrück Center
+49 30 9406-2157
ewanker@mdc-berlin.de
Christina Anders
Redakteurin, Kommunikation
Max Delbrück Center
+49 30 9406-2118
christina.anders@mdc-berlin.de oder presse@mdc-berlin.de
- Max Delbrück Center
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.