Geheimnisvolle Sensoren im Rückenmark
Egal ob es darum geht, an Nahrung und Trinkwasser zu gelangen, vor potenziellen Fressfeinden zu flüchten, Balance zu halten oder einen sexuellen Akt zu vollziehen: Fast alle Tiere sind auf komplexe Bewegungsmuster angewiesen, um zu überleben – und müssen sie zudem permanent an die äußeren Gegebenheiten anpassen. Um die Bewegungen zu justieren, ist ein Abgleich verschiedener sensorischer Informationen erforderlich. Die Signale werden dann an die motorischen Neuronen weitergeleitet, die alle Muskelaktivitäten steuern.
Lange bekannt, aber kaum erforscht
Katrin Gerstmann und Niccolo Zampieri
Sinneszellen der Augen oder der Haut zum Beispiel sind gut erforscht. Wenig Aufmerksamkeit bekam hingegen ein inneres Sinnesorgan: eine Gruppe von Neuronen, die den Zentralkanal des Rückenmarks auskleidet und dort über einen mit Zilien (Flimmerhärchen) besetzten Fortsatz der Zellen mit dem Liquor – auch Zerebrospinalflüssigkeit, kurz CSF genannt – in Kontakt steht. „Bekannt sind diese CSF-kontaktierenden Neuronen seit etwa einhundert Jahren. Sie sind in allen Wirbeltieren zu finden“, sagt Dr. Niccolò Zampieri, der Leiter der Arbeitsgruppe „Entwicklung und Funktion neuraler Netzwerke“ am Berliner Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC). „Unser Team ist allerdings das erste, das die Funktion dieser Zellen bei Säugetieren untersucht hat.“
Die Ergebnisse ihrer Experimente stellen Zampieri und seine Kolleg*innen in der Fachzeitschrift „Current Biology“ vor. Erstautorin der Publikation ist Dr. Katrin Gerstmann aus Zampieris Team. Maßgeblich beteiligt an der Arbeit waren zudem Dr. Nina Jurčić und Professor Nicolas Wanaverbecq vom Institut de Neurosciences de la Timone der französischen Université d'Aix-Marseille. „Am wichtigsten ist die Erkenntnis, dass die CSF-kontaktierenden Neuronen für die Feinjustierung von bestimmten Bewegungen der Mäuse zentral sind“, sagt Gerstmann. „Ohne die Zellen können die Tiere in Situationen, in denen sie ihre Körperachse krümmen müssen, ihre Bewegungen weniger präzise kontrollieren.“
Direkt mit Motoneuronen verbunden
Frühere Studien hatten gezeigt, dass die CSF-kontaktierenden Neuronen bei Zebrafischen und Neunaugen den pH-Wert des Liquors messen und Bewegungen der Wirbelsäule wahrnehmen können. „Seither weiß man auch, dass diese Zellen das Schwimmverhalten der Tiere mitsteuern“, sagt Gerstmann. „In unserer Studie wollten wir herausfinden, welche Funktionen die Neuronen bei Säugetieren haben, die sich auf vier Beinen fortbewegen.“ Als sie die angefärbten Zellen unter dem Mikroskop analysierten, konnten die Forscherinnen und Forscher sehen, dass die CSF-kontaktierenden Neuronen direkt mit Motoneuronen verbunden sind.
Für ihre weiteren Experimente schalteten die Wissenschaftler*innen die Zellen gezielt aus. „Wir wollten zunächst sehen, ob die Mäuse dann ein generelles Problem mit ihrer Motorik haben“, erzählt Gerstmann. Deshalb setzte das Team die Mäuse in spezielle Boxen mit Lichtschranken. So kann man Geschwindigkeit, Pausen und zurückgelegte Distanzen nachvollziehen. „Dabei konnten wir aber keine Unterschiede zu den Mäusen aus der Kontrollgruppe entdecken“, berichtet Gerstmann Auch eine anspruchsvollere Ganganalyse mit einer Hochgeschwindigkeitskamera habe keine Auffälligkeiten gezeigt. „Daraus schlossen wir, dass die CSF-kontaktierenden Neuronen weder die allgemeine motorische Aktivität noch die alternierenden Beinbewegungen von Säugetieren beeinflussen“, sagt Gerstmann.
Unsicher auf dem Schwebebalken
Ohne CSF-kontaktierende Neuronen waren die Tiere langsamer und rutschten häufiger ab, wenn sie sich beim Balancieren lang machen und ihre Körperachse krümmen mussten.
Sichtbar wurden die Veränderungen erst, als die Forscher*innen die Mäuse über einen schmalen Schwebebalken oder über horizontale Leitern lockten, auf denen sich die Tiere beim Balancieren lang machen und ihre Körperachse krümmen mussten. „Die Mäuse, bei denen wir die CSF-kontaktierenden Neuronen ausgeschaltet hatten, waren langsamer und rutschten häufiger ab“, berichtet Gerstmann. Die gleichen Ergebnisse konnte das Team beobachteten, wenn sie verhinderten, dass die Neuronen ein Zilium ausbildeten. „Anscheinend ist das Zilium für die Funktion der CSF-kontaktierenden Neuronen entscheidend“, sagt Gerstmann. Fische brauchen einen Ionenkanal namens PKD2L1, um solche Bewegungen zu steuern. In den Zellen von Säugetieren erwies sich dieser Kanal aber überraschenderweise für diese Aufgabe als bedeutungslos.
„Welche Sinneseindrücke die CSF-kontaktierenden Neuronen genau registrieren und welche Rezeptoren sie dazu nutzen, wissen wir allerdings noch nicht“, ergänzt Zampieri. Das wolle das Team nun in weiteren Experimenten und mithilfe molekularer Untersuchungen herausfinden. Denkbar sei beispielsweise, dass die Zellen die Strömungen des Liquors erkennen oder auch dessen chemische Zusammensetzung – der sich sowohl während der Entwicklung der Tiere als auch im Tagesverlauf sowie bei Krankheit oder Ermüdung verändere.
Kontakt zu vielen Organen
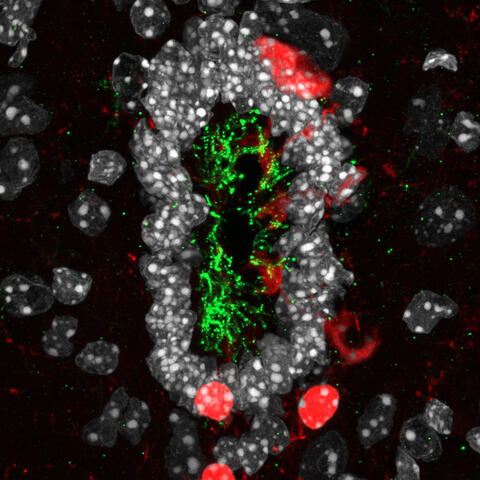
In 64-facher Vergrößerung kann man auf diesem Bild auch die Zilien (grün) der CSF-kontaktierenden Neuronen (rot) erkennen.
„Gesehen haben wir zudem, dass die CSF-kontaktierenden Zellen nicht nur mit motorischen Neuronen in Verbindung stehen, sondern auch mit solchen Neuronen des Rückenmarks, die die inneren Organe, die glatte Muskulatur und die Drüsensekretion regulieren können“, berichtet Zampieri. „Die Zellen könnten somit Teil eines neuroendokrinen Systems sein, das auch andere Aspekte der Physiologie von Säugetieren moduliert.“ Spannend bleibe darüber hinaus die Frage, wie die CSF-kontaktierenden Neuronen mit anderen Zellen zusammenarbeiten, um die exakte Ausführung komplizierter Bewegungsmuster zu meistern, sagt der Forscher. Er will den Sensoren im Rückenmark also noch eine Menge Geheimnisse entlocken.
Text: Anke Brodmerkel
Weiterführende Informationen
Literatur
Katrin Gerstmann et al. (2022): “The role of intraspinal sensory neurons in the control of quadrupedal locomotion.” Current Biology, DOI: 10.1016/j.cub.2022.04.019
Fotos zum Download
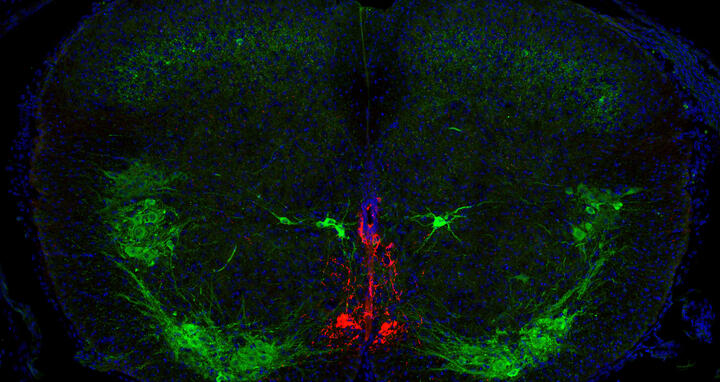
- Ein Querschnitt durch den Zentralkanal des Rückenmarks einer Maus. In Rot sind die CSF-kontaktierenden Zellen zu sehen, Motoneuronen sowie eine andere Zellpopulation in der Nähe des Kanals sind grün angefärbt. Foto: AG Zampieri, MDC
- In 64-facher Vergrößerung kann man auf diesem Bild auch die Zilien (grün) der CSF-kontaktierenden Neuronen (rot) erkennen. Foto: AG Zampieri, MDC
- Ohne CSF-kontaktierende Neuronen waren die Tiere langsamer und rutschten häufiger ab, wenn sie sich beim Balancieren lang machen und ihre Körperachse krümmen mussten. Foto: AG Zampieri, MDC
Kontakte
Dr. Niccolò Zampieri
Leiter der Arbeitsgruppe „Entwicklung und Funktion neuraler Netzwerke“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Niccolo.Zampieri@mdc-berlin.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.