Genmutation in Chloridkanal löst seltenes Bluthochdrucksyndrom aus
Unser Blutdruck wird unter anderem von Hormonen reguliert. Eine nicht zu unterschätzende Rolle spielt dabei das Steroidhormon Aldosteron. Es wird in den Nebennieren gebildet und ist an der Regulation des Wasser- und Salzhaushalts des Körpers beteiligt. Beim Hyperaldosteronismus produzieren die Nebennieren zu viel Aldosteron, wodurch Natrium im Körper zurückgehalten wird und vermehrt Kalium ausgeschieden wird. Die Folge ist ein krankhaft erhöhter Blutdruck, weshalb man auch von sekundärem Bluthochdruck spricht. Auch die Nieren nehmen oft Schaden.
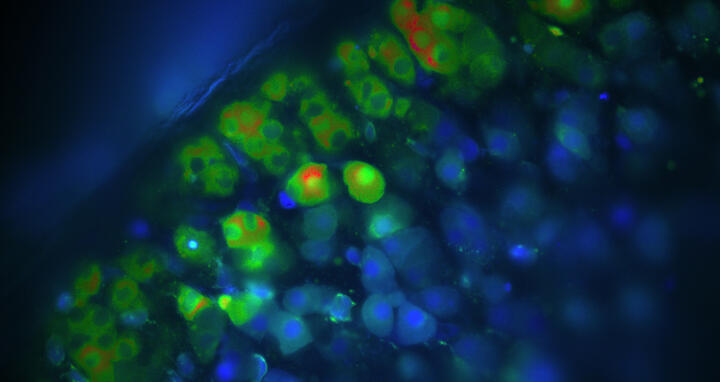
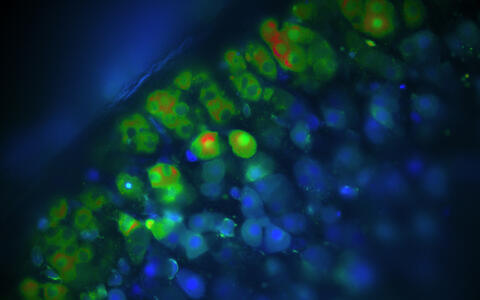
Kalziummessungen von Aldosteron-produzierenden Zellen der Nebenniere. Sind die Zellen blau, ist die Kalziumkonzentration in diesen Zellen niedrig. Grüne und rote Zellen haben eine erhöhte Kalziumkonzentration, sodass sie Aldosteron produzieren.
Bis vor kurzem wusste man wenig über die pathologischen Mechanismen der auch als Conn-Syndrom bezeichneten Erkrankung. Im Jahr 2018 konnten die Pariser Wissenschaftlerinnen und Wissenschaftler um Professorin Maria-Christina Zennaro in Zusammenarbeit mit den Berliner Kolleginnen und Kollegen vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und dem Max-Delbrück-Centrum (MDC) sowie eine weitere Gruppe aus Deutschland und den USA um Professorin Ute Scholl vom Berlin Institute of Health (BIH) und der Charité – Universitätsmedizin Berlin erstmals nachweisen, dass bei betroffenen Erkrankten eine Mutation im Gen für den ClC-2 Chloridkanal vorliegt. Sechs verschiedene Mutationen wurden bislang beschrieben, sie sind 2018 in Nature Genetics publiziert worden. Unklar war allerdings der kausale Zusammenhang zwischen Genmutation und Überproduktion von Aldosteron. Diese Lücke haben nun die Forscherinnen und Forscher vom FMP und MDC geschlossen.
Kausalität zwischen Mutation und Krankheit bewiesen
Das Team um Professor Thomas Jentsch, der die erste Chloridkanalfamile, zu der auch ClC-2 gehört, vor fast 30 Jahren als Erster entdeckt hatte, untersuchte die beschriebenen Mutationen zunächst in vitro. Dabei fanden die Forscherinnen und Forscher, dass alle bisher bekannten, vermeintlich Hyperladosteronismus verursachenden ClC-2 Mutationen den Chloridstrom des Kanals drastisch erhöhen.
Um den Beweis zu erbringen, dass die Erhöhung des Chloridstroms von ClC-2 zu Hyperaldosteronismus führt, haben die Forscherinnen und Forscher anschließend ein Mausmodell entwickelt, das ClC-2 über eine andere, ‚künstliche‘ Mutation aktiviert. Die genetisch veränderten Mäuse wiesen enorm erhöhte Chloridströme in den Aldosteron-absondernden Zellen auf, was unter anderem zu einem starken, pathologischen Anstieg der Aldosteron-Konzentration im Blut der Nager führte. Daraus resultierte – genau wie bei Patientinnen und Patienten – ein krankhaft erhöhter Blutdruck und sekundär eine verringerte Renin-Aktivität, ein Hormon, das normalerweise die Aldosteronproduktion erhöht. Somit konnten die Forscher den Nachweis erbringen, dass die Mutation ursächlich an der Krankheitsentstehung beteiligt ist. Die Ergebnisse der Arbeit sind nun im Fachjournal Nature Communications erschienen.
Der Chloridkanal ist immer geöffnet
„Wir haben gesehen, dass der Kanal durch die Mutationen ständig geöffnet ist, wodurch die elektrische Spannung über die Zellmembran der Hormon-produzierenden Zelle stark verändert wird. Dadurch kommt es zu einem Einstrom von Kalzium, was wiederum zu einer Überproduktion von Aldosteron führt“, erläutert Dr. Corinna Göppner, die zusammen mit Dr. Ian Orozco Erstautorin der Studie ist und gerade über ClC-2 promoviert hat.
„Was sich aufgrund des mutierten Chloridkanals genau im Organismus abspielt, das haben wir an unserem Modell erstmals Schritt für Schritt in allen Details zeigen können“, sagt die Biologin. „Insofern hat unsere Arbeit hervorragend die humangenetischen Befunde ergänzt und erweitert.“
Das beste Modell, um die Krankheit zu erforschen
Das in Berlin-Buch entwickelte Maus-Modell ist das erste In-vivo-Modell, das die Krankheit mit all seinen Symptomen abbildet, und gilt als das bisher beste seiner Art. Es ist also perfekt dafür geeignet, die pathologischen Mechanismen des Hyperaldosteronismus weiter zu erforschen und sekundäre Effekte wie Langzeitschäden zu identifizieren. Leichte Nierenschäden konnten die Forscher bereits sehen, aber sie erhoffen sich noch mehr davon: „Wir gehen im Moment davon aus, dass ein ständig geöffneter Chloridkanal auch Einfluss auf andere Organe haben könnte“, sagt Gruppenchef Thomas Jentsch. Hierüber wisse die Medizin derzeit leider noch wenig, dabei sei das Thema Langzeitfolgen für Patienten hoch relevant. „Unser Mausmodell kann definitiv bei der Aufklärung helfen, was wieder mal die Relevanz der Grundlagenforschung für die Klinik zeigt.“ (fmp)
Weiterführende Informationen
Literatur
Corinna Göppner, Ian J. Orozco et al. (2019): „Pathogenesis of hypertension in a mouse model for human CLCN2 related hyperaldosteronism”. Nature Communications, DOI: 10.1038/s41467-019-12113-9.
Kontakte
Prof. Thomas J. Jentsch
Leiter der Arbeitsgruppe „Physiologie und Pathologie des Ionentransportes“
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-2961
Jentsch@mdc-berlin.de
Silke Oßwald
Leitung, Öffentlichkeitsarbeit
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP)
+49-30-94793-104
osswald@fmp-berlin.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49(0)30-9406-2121
jana.schluetter@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.
Das Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP)
Das Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) gehört zum Forschungsverbund Berlin e.V. (FVB), einem Zusammenschluss von acht natur-, lebens- und umweltwissenschaftlichen Instituten in Berlin. In ihnen arbeiten mehr als 1.900 Mitarbeiter. Die vielfach ausgezeichneten Einrichtungen sind Mitglieder der Leibniz-Gemeinschaft. Entstanden ist der Forschungsverbund 1992 in einer einzigartigen historischen Situation aus der ehemaligen Akademie der Wissenschaften der DDR.