Herzatlas mit Tiefenschärfe
Tag für Tag schlägt das menschliche Herz zuverlässig rund 100.000 Mal. Es pumpt das Blut immer nur in eine Richtung durch die vier verschiedenen Kammern; die Geschwindigkeit variiert bei Ruhe, während des Sports und bei Stress. Dafür müssen die Zellen in jedem Teil des Herzens bei jedem Herzschlag koordiniert vorgehen. Wie dem Organ diese anspruchsvolle Aufgabe gelingt, ist bislang allerdings erstaunlich wenig bekannt. Dabei stellt es so sicher, dass jeder Winkel des Körpers über das Blut permanent mit Nährstoffen und Sauerstoff versorgt ist und dass Kohlendioxid und Abfallstoffe abtransportiert werden.
Professor Norbert Hübner, der Leiter der Arbeitsgruppe „Experimentelle Genomik von Herz-Kreislauf-Erkrankungen“ am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), hat gemeinsam mit Dr. Sarah Teichmann vom Wellcome Sanger Institute im britischen Cambridge, Professor Jonathan Seidmann und Professorin Christine Seidmann, beide von der Harvard Medical School in Boston, und Dr. Michela Noseda vom Imperial College London vor rund drei Jahren ein Projekt namens „Human Heart Cell Atlas“ ins Leben gerufen, mit dem sie das Herz Zelle für Zelle verstehen möchten. Der Atlas der Herzzellen ist Teil des internationalen Großprojekts „Human Cell Atlas“ und wird von der Chan Zuckerberg Initiative mit knapp vier Millionen US-Dollar sowie vom Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK) und der British Heart Foundation mit 2,5 Millionen Euro gefördert.
Erkenntnisse aus rund einer halben Million Zellen und Zellkernen
Dies ist das erste Mal, dass sich irgendjemand in diesem Maßstab einzelne Zellen des menschlichen Herzens angeschaut hat.
Die an dem Projekt beteiligten Teams aus 33 Wissenschaftlerinnen und Wissenschaftlern, die an 19 Institutionen in Deutschland, Großbritannien, den USA, Kanada, China und Japan forschen, haben rund eine halbe Million einzelne Zellen und Zellkerne des menschlichen Herzens analysiert. Jetzt können sie einen ersten ausführlichen Entwurf des Herzzellatlas im Fachblatt „Nature“ vorlegen. Er zeigt eine enorme Vielfalt der Zellen und enthüllt zuvor unbekannte Subtypen von Herzmuskelzellen und stützenden Herzzellen, schützende Immunzellen des Herzens und ein weit verzweigtes Netzwerk von Blutgefäßzellen. Sie errechnen zudem, wie die Zellen kommunizieren, um das Herz in Gang zu halten.
„Dies ist das erste Mal, dass sich irgendjemand in diesem Maßstab einzelne Zellen des menschlichen Herzens angeschaut hat. Das ist erst durch umfangreiche Einzelzellsequenzierung möglich geworden“, sagt Professor Norbert Hübner, ein Hauptautor vom MDC, der Charité – Universitätsmedizin Berlin, dem Berlin Institute of Health (BIH) und dem DZHK in Deutschland. „Diese Studie zeigt, was diese Technik und internationale Kooperationen leisten können. Das gesamte Spektrum der Herzzellen und ihre Genaktivität zu kennen, ist eine grundlegende Notwendigkeit. Nur so kann man verstehen, wie das Herz funktioniert und wie es auf Stress und Krankheit reagiert.“
Professorin Christine Seidman, eine Hauptautorin vom Brigham and Women’s Hospital, der Harvard Medical School und dem Howard Hughes Medical Institute, sagt: „Millionen Menschen werden wegen Herz-Kreislauf-Erkrankungen behandelt. Wir wollen zunächst das gesunde Herz verstehen. So können wir nachvollziehen, wie das Zusammenspiel von Zelltypen und Zellzuständen lebenslange Leistungsfähigkeit ermöglichen kann und wie sich dieses Zusammenspiel während einer Erkrankung unterscheidet. Letztendlich können diese grundlegenden Erkenntnisse auf spezifische Ziele hinweisen, die zu maßgeschneiderten Therapien der Zukunft führen und damit eine personalisierte Medizin für Herzkrankheiten schaffen, die für jeden Patienten und jede Patientin die Wirksamkeit der Behandlung verbessert.“ Herz-Kreislauf-Erkrankungen sind weltweit die häufigste Todesursache. Jedes Jahr sterben daran 17,9 Millionen Menschen, meist aufgrund eines Infarkts oder eines Schlaganfalls.
Ein heterogenes Organ
Für ihre Arbeit konnten die Forscherinnen und Forscher sieben weibliche und sieben männliche Herzen hirntoter, aber herzgesunder Spender*innen zwischen 40 und 75 Jahren aus Europa und den USA nutzen, die für eine Transplantation aus unterschiedlichen Gründen nicht in Frage kamen. Um die Herzzellen möglichst genau zu charakterisieren, haben die Forscher*innen untersucht, welche Gene in den einzelnen Zellen und Zellkernen aus sechs verschiedenen Herzregionen jeweils angeschaltet sind. Dazu gehörten die rechten und linken Vorhöfe und Kammern, die Herzspitze, Apex genannt, und das Ventrikelseptum, das die beiden Herzkammern voneinander trennt. Das Herz ist schließlich ein ziemlich heterogenes Organ. Die Blutdruckunterschiede zwischen den rechten und linken Vorhöfen und Kammern beispielsweise sind ganz enorm.
Mit modernen Methoden der Einzelzellsequenzierung, die sie zuvor an die Besonderheiten des Herzgewebes angepasst hatten, mit maschinellem Lernen und Bildgebungsverfahren haben die Wissenschaftler*innen herausgefunden, dass sich die Zellen in diesen Regionen stark voneinander unterscheiden. In jeder Region gab es ein spezifisches Set von Zellen, was Unterschiede in der Entwicklung unterstreicht und möglicherweiser zu unterschiedlichen Reaktionen auf eine Behandlung führt.
Alle bisher bekannten Zelltypen des Herzens besitzen außerdem zahlreiche Subtypen. Es gibt beispielsweise nicht die eine Herzmuskelzelle, sondern viele verschiedene Kardiomyozyten mit teilweise ganz unterschiedlichen Funktionen. Die Genexpressionsmuster legen nahe, dass manche von ihnen mit einer viel höheren Stoffwechselrate umgehen können als andere. Warum das so ist, können die Forscher*innen noch nicht sagen. Auch bei den Fibroblasten, die das Bindegewebe des Organs ausmachen, fanden sie sehr unterschiedliche Muster der Genexpression.
Zu viel Gerüstmaterial
Mit dem Zellatlas des menschlichen Herzens haben wir die Grundlage geschaffen, um fibrotische Prozesse wirklich zu verstehen.
Nach einem Herzinfarkt versuchen die Fibroblasten, so viel geschädigtes Herzgewebe wie möglich mit einem stützenden Gerüst zu ersetzen. So soll es weiterhin den Kräften standhalten, die mit einem normalen Herzschlag verbunden sind. Manchmal setzen sie dabei zuviel Gerüstmaterial – oder extrazelluläre Matrix (ECM) – ein. Dieses zusätzliche Narbengewebe führt oft zu Herzrhythmusstörungen und Herzversagen.
„Wir haben verschiedene Fibroblasten-Subtypen gesehen: Manche produzieren die extrazelluläre Matrix über unterschiedliche Prozesse, andere bauen das Gerüst um, wieder andere kommunizieren mit Immunzellen in ihrer direkten Nachbarschaft. Auch das könnte beeinflussen, wie viel Narbengewebe entsteht“, sagt die MDC-Forscherin Dr. Henrike Maatz aus der Arbeitsgruppe von Hübner, die eine der vier Erstautor*innen der Studie ist. „Mit dem Zellatlas des menschlichen Herzens haben wir die Grundlage geschaffen, um fibrotische Prozesse wirklich zu verstehen: Warum verlaufen sie in den Vorhöfen und Kammern jeweils anders? Wie können wir sie kontrollieren?“
Unerwartet war zudem die Beobachtung, dass die Herzen der Frauen in ihren Kammern mehr Muskel- und weniger Bindegewebszellen aufweisen als die der Männer – obwohl weibliche Herzen in der Regel kleiner sind als männliche. Das Resultat könne erklären, warum Frauen seltener als Männer an Herz-Kreislauf-Leiden erkranken. „Das ist faszinierend, aber das Ergebnis basiert auf nur sieben Herzen jedes Geschlechts. Wir müssen mal schauen, ob dieses Ergebnis weiteren Untersuchungen standhält“, sagt Maatz.
In kleine Bereiche heranzoomen
Auch die Blutgefäße, die das Herz durchziehen, untersuchten die Forscher*innen in dieser Studie so detailliert wie noch nie. Der Atlas zeigte, wie sich die Zellen in Venen und Arterien an die verschiedenen Drücke und Umgebungen angepasst haben. Das könnte zum Verständnis dessen beitragen, was bei koronarer Herzkrankheit in den Blutgefäßen schief läuft.
Dr. Michela Noseda, eine Hauptautorin vom National Heart and Lung Institute, Imperial College London, sagt: „Unsere internationalen Anstrengungen liefern der Wissenschaft Informationen von unschätzbarem Wert. Sie beleuchten die zellulären und molekularen Details der Herzzellen, die gemeinsam Blut durch den Körper pumpen. Wir haben Herzzellen kartiert, die potenziell mit SARS-CoV-2 infiziert werden können. Dabei haben wir herausgefunden, dass spezialisierte Zellen der kleinen Blutgefässe ebenfalls Angriffsziele des Virus sind. Unsere Datensätze sind eine Goldgrube an Informationen, um die Feinheiten von Herzkrankheiten zu verstehen.“
Lange Zeit konnten Wissenschaftler*innen quasi nur von oben auf die Landkarte des Herzens schauen. Mithilfe der Einzelzellsequenzierung können sie nun erstmals in kleine Bereiche reinzoomen.
Diese großartige Gemeinschaftsarbeit gehört zur globalen Initiative des Human Cell Atlas, eine 'Google-Map' des menschlichen Körpers zu erstellen.
Dr. Sarah Teichmann, eine Hauptautorin des Wellcome Sanger Instituts und Ko-Vorsitzende des Organisationskomitees für den „Human Cell Atlas“, sagt: „Diese großartige Gemeinschaftsarbeit gehört zur globalen Initiative des Human Cell Atlas, eine 'Google-Map' des menschlichen Körpers zu erstellen. Der Herzzellatlas, der Forscher*innen auf der ganzen Welt offen zur Verfügung steht, ist eine fantastische Ressource. Der Atlas wird zu einem neuen Verständnis von Herzgesundheit und -krankheit, zu neuen Behandlungen und möglicherweise sogar zu neuen Wegen führen, geschädigtes Herzgewebe zu regenerieren.“
Finanzielle Förderung
Diese Studie wurde unterstützt von der British Heart Foundation (BHF), dem Europäischen Forschungsrat (ERC), dem Bundesministerium für Bildung und Forschung (BMBF), dem Deutschen Zentrum für Herz-Kreislaufforschung e.V. (DZHK), der Leducq Fondation, der Deutschen Forschungsgemeinschaft (DFG), Chinese Council Scholarship (CSC), der Alexander von Humboldt-Stiftung, EMBO, CIHR Canadian Institutes for Health Research, HSF Heart and Stroke Foundation, AI Alberta Innovates, der Chan Zuckerberg Initiative, dem Wellcome Sanger Institute, Wellcome, NIH und dem Howard Hughes Medical Institute.
Weiterführende Informationen
- Alle Daten dieser Studie können online eingesehen werden.
- WHO-Statistik zu Herz-Kreislauf-Erkrankungen
- Wie das Herz funktioniert (Webseite der Deutschen Herzstiftung)
- Pressemitteilung: „Mitten ins Herz“
- Pressemitteilung: „Herzzellen ihre Geheimnisse entlocken“
Literatur
Monika Litviňuková, Carlos Talavera-López, Henrike Maatz, Daniel Reichart et al. (2020): „Cells of the adult human heart“. Nature, DOI: 10.1038/s41586-020-2797-4.
Fotos zum Download
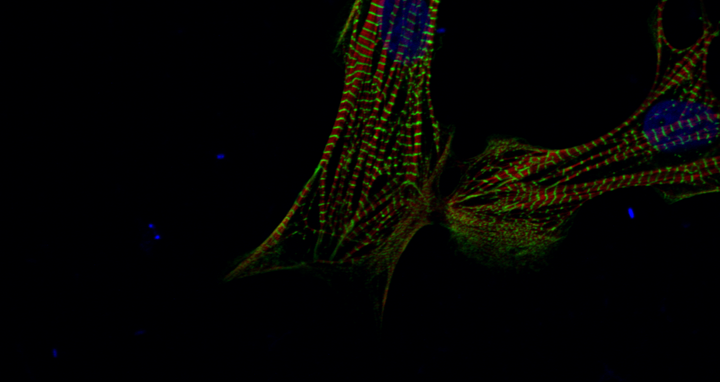
Menschliche Herzmuskelzellen, die aus induzierten pluripotenten Stammzellen entstanden sind. Foto: Sebastian Diecke, MDC
Kontakte
Professor Norbert Hübner
Leiter der AG „Experimentelle Genetik von Herz-Kreislauferkrankungen“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-3512 (Sekretariat)
nhuebner@mdc-berlin.de
Dr. Henrike Maatz
Postdoktorandin in der AG Hübner
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
h.maatz@mdc-berlin.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) wurde 1992 in Berlin gegründet. Es ist nach dem deutsch-amerikanischen Physiker Max Delbrück benannt, dem 1969 der Nobelpreis für Physiologie und Medizin verliehen wurde. Aufgabe des MDC ist die Erforschung molekularer Mechanismen, um die Ursachen von Krankheiten zu verstehen und sie besser zu diagnostizieren, verhüten und wirksam bekämpfen zu können. Dabei kooperiert das MDC mit der Charité – Universitätsmedizin Berlin und dem Berlin Institute of Health (BIH) sowie mit nationalen Partnern, z.B. dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DHZK), und zahlreichen internationalen Forschungseinrichtungen. Am MDC arbeiten mehr als 1.600 Beschäftigte und Gäste aus nahezu 60 Ländern; davon sind fast 1.300 in der Wissenschaft tätig. Es wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Berlin finanziert und ist Mitglied in der Helmholtz-Gemeinschaft deutscher Forschungszentren. www.mdc-berlin.de
Das Wellcome Sanger Institute
Das Wellcome Sanger Institute ist ein weltweit führendes Genom-Forschungszentrum. Wir führen groß angelegte Forschungsarbeiten durch, die die Grundlagen des Wissens in der Biologie und Medizin bilden. Wir sind offen und kooperativ; unsere Daten, Ergebnisse, Tools und Technologien werden weltweit ausgetauscht, um die Wissenschaft voranzubringen. Unser Ehrgeiz ist groß - wir übernehmen Projekte, die anderswo nicht möglich sind. Wir nutzen die Möglichkeiten der Genomsequenzierung, um die Informationen in der DNA zu verstehen und nutzbar zu machen. Dank der Finanzierung durch Wellcome haben wir die Freiheit und Unterstützung, die Grenzen der Genomik zu verschieben. Unsere Erkenntnisse werden genutzt, um die Gesundheit zu verbessern und das Leben auf der Erde zu verstehen. Erfahren Sie mehr unter www.sanger.ac.uk
Wellcome
Wellcome dient der Verbesserung der Gesundheit, indem die Stiftung großen Ideen zum Erfolg verhilft. Wir unterstützen Forscher*innen, wir stellen uns großen gesundheitlichen Herausforderungen, wir setzen uns für eine bessere Wissenschaft ein, und wir helfen allen, sich für Wissenschaft und Gesundheitsforschung zu engagieren. Wir sind eine politisch und finanziell unabhängige Stiftung. https://wellcome.ac.uk/
Das Imperial College London
Das Imperial College London ist eine der führenden Universitäten weltweit. Die 17.000 Studenten und 8.000 Mitarbeiter des Colleges verschieben die Grenzen des Wissens in Wissenschaft, Medizin, Technik und Wirtschaft und setzen ihre Entdeckungen in Vorteile für unsere Gesellschaft um. Imperial ist laut Times Higher Education die internationalste Universität Großbritanniens mit akademischen Verbindungen zu mehr als 150 Ländern. Reuters zeichnete das College aufgrund seiner außergewöhnlichen Unternehmenskultur und seiner Verbindungen zur Industrie als die innovativste Universität Großbritanniens aus. http://www.imperial.ac.uk/
Die Harvard Medical School
An der Harvard Medical School arbeiten mehr als 11.000 Wissenschaftlerinnen und Wissenschaftler in den elf Abteilungen zur Grundlagen- und Sozialwissenschaft, die das Blavatnik Institute bilden und an den 15 Lehrkrankenhäusern und Forschungsinstituten, die mit Harvard affiliiert sind: Beth Israel Deaconess Medical Center, Boston Children’s Hospital, Brigham and Women’s Hospital, Cambridge Health Alliance, Dana-Farber Cancer Institute, Harvard Pilgrim Health Care Institute, Hebrew SeniorLife, Joslin Diabetes Center, Judge Baker Children’s Center, Massachusetts Eye and Ear/Schepens Eye Research Institute, Massachusetts General Hospital, McLean Hospital, Mount Auburn Hospital, Spaulding Rehabilitation Network und das VA Boston Healthcare System. www.hms.harvard.edu