Neue Therapie-Chancen für Multiple Sklerose in Sicht
Man nennt sie auch die Krankheit der tausend Gesichter. Denn sowohl die Symptome als auch der Verlauf der Multiplen Sklerose (MS) unterscheiden sich stark von Patient*in zu Patient*in. Gleich ist bei allen Erkrankten jedoch eines: Zellen des eigenen Immunsystems wandern bei ihnen ins Gehirn ein und zerstören dort die Myelinscheiden, die schützende äußere Schicht der Nervenfasern. Das hat zur Folge, dass es im Gehirn zu elektrischen „Kurzschlüssen“ kommt und Nervensignale nicht mehr richtig weitergeleitet werden.
Viele MS-Medikamente schwächen das Immungedächtnis
Welche Immunzellen an dem Abbau der Myelinscheiden beteiligt sind, wissen Forschende noch nicht im Detail. Autoreaktive T- und B-Zellen, die aufgrund eines Fehlers die Myelinscheiden im Gehirn als körperfremd erkennen, wandern in das Gehirn ein und initiieren die Erkrankung. „Daher richten sich die bisher verfügbaren MS-Medikamente im Wesentlichen gegen diese T- und B-Zellen, die beide zum erworbenen Immunsystem gehören“, sagt der Forschungsleiter der aktuellen Publikation im Fachblatt „Nature Immunology“, Dr. Alexander Mildner vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC).
Dr. Alexander Mildner untersucht die Entwicklung von bestimmten Immunzellen, den Monozyten und Makrophagen. Diese Zellen sind wichtig für die Immunabwehr gegen Mikroorganismen, aber sie spielen auch bei Autoimmun-Erkrankungen wie der Multiplen Sklerose eine wichtige Rolle.
Mildner forscht zurzeit als DFG Heisenberg-Stipendiat mit eigenen Mitteln in der MDC-Arbeitsgruppe „Zelldifferenzierung und Tumorigenese“ von Professor Achim Leutz. „Durch ihren Angriff auf das erworbene Immunsystem beeinträchtigen die MS-Medikamente allerdings das Immungedächtnis des Körpers, der damit langfristig anfälliger für Infektionen sein kann“, sagt der Wissenschaftler.
Ohne Monozyten besserten sich bei Mäusen die MS-Symptome
Mildner verfolgt daher seit ein paar Jahren eine andere Strategie. Er will herausfinden, welche Rolle Immunzellen bei der Entstehung der MS spielen, die zur angeborenen Körperabwehr gehören – und ob nicht auch sie eine geeignete Zielstruktur für die Therapie der Erkrankung sind. „In einer früheren Studie mit einem Mausmodell für die Multiple Sklerose konnten wir bereits zeigen, dass die Krankheitssymptome der Tiere innerhalb von nur wenigen Tagen stark zurückgingen, wenn Antikörper spezifisch deren Monozyten zerstörten“, berichtet der Forscher. Das habe ihn und auch viele seiner Kolleginnen und Kollegen damals sehr überrascht.
„Offenbar sind also nicht nur T- und B-Zellen an dem Gewebeschaden der MS beteiligt“, sagt Mildner. Bei den von ihm untersuchten Monozyten handelt es sich um eine spezielle Form weißer Blutkörperchen, die eine Zeit lang im Blut zirkulieren, bevor sie ins Gewebe auswandern. Dort verwandeln sie sich in Fresszellen, die körperfremdes Gewebe – oder das, was sie wie bei der MS irrtümlich dafür halten – zerstören. Das führe zu Entzündungen im Gehirn, sagt Mildner.
Das Team stieß auf unbekannte Formen von Monozyten
Für die anschließende Transkriptomanalyse werden einzelne Monozyten aus dem zentralen Nervensystem in Platten sortiert, was Alexander Mildner am Mikroskop kontrolliert.
Auch in der aktuellen in Nature Immunology erschienenen Studie, die er gemeinsam mit einem israelischen Team um Professor Ido Amit vom Department of Immunology am Weizmann Institute of Science in Rehovot vorgenommen hat, konzentrierten sich Mildner und sein Team auf die Monozyten. „Wir wissen, dass es mehrere Formen dieser Immunzellen gibt, die unterschiedliche Aufgaben besitzen“, sagt der Wissenschaftler. „In unserem Mausmodell der MS wollten wir die Zellen daher per Einzelzell-Sequenzierung genauer untersuchen und herausfinden, welche Monozyten bei MS im Gehirn vorhanden sind.“
Er und seine Kolleg*innen stießen dabei auf sechs verschiedene Monozyten-Subtypen, von denen vier bisher noch unbekannt gewesen waren. Wie in seiner früheren Studie injizierte Mildner den Mäusen Antikörper gegen ein spezifisches Oberflächenprotein der Monozyten. Wie erwartet starben die Zellen daraufhin ab und die MS-Symptome der Tiere verringerten sich innerhalb kürzester Zeit. „Überraschend für uns war allerdings die Beobachtung, dass die Antikörper nicht alle Monozyten im Gehirn zerstörten, die dieses Oberflächenprotein besitzen“, sagt Mildner.
Nicht alle Monozyten zerstören das schützende Myelin
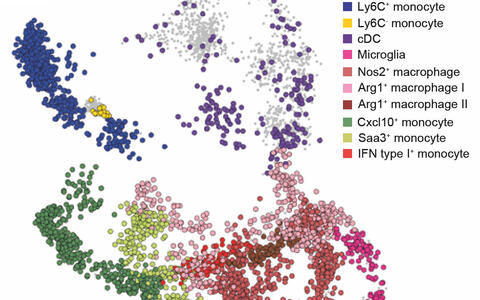
Einzelzellanalyse - Die Monozyten können anhand ihrer Transkriptomähnlichkeit zueinander in definierte Gruppen eingeteilt werden (hier angedeutet durch die unterschiedlichen Farben).
„Nur eine ganz bestimmte Form der Monozyten, die Cxcl10+-Zellen, ging durch die Antikörper-Behandlung zugrunde“, sagt Mildner. „Offenbar sind sie also diejenigen Zellen, welche vorrangig die MS-typischen Gewebeschäden im Gehirn hervorrufen.“ Wie er und sein Team mit der Einzelzell-Sequenzierung zudem herausgefunden haben, unterscheidet sich dieser Zelltyp von den anderen Monozyten in zwei wesentlichen Punkten. Zum einen besitzen Cxcl10+-Zellen besonders viele Rezeptoren für einen von T-Zellen abgegebenen Signalstoff, der in Monozyten gewebeschädigende Eigenschaften hervorruft. Zum anderen produzieren diese Zellen besonders viel Interleukin-1-Beta, eine Substanz, die die Blut-Hirn-Schranke öffnet, so dass die Zellen leichter vom Blut ins Gehirn gelangen können. „Unsere Forschung legt nahe, dass T-Zellen als Krankheitsinitiatoren ins zentrale Nervensystem (ZNS) wandern, um dann dort Monozyten anzulocken, die für den primären Gewebeschaden verantwortlich sind“, erläutert Mildner.
Womöglich seien die anderen Monozyten sogar an Reparaturprozessen beteiligt, bei denen der Körper versuche, das beschädigte Myelin wieder neu aufzubauen, spekuliert Mildner. Aufgrund der Ergebnisse seiner Studie hält er es zudem für denkbar, dass die T- und B-Zellen am Abbau der Myelinscheiden gar nicht direkt beteiligt sind, sondern nur indirekt: indem sie die Cxcl10+-Monozyten dazu bringen, die schützende Hülle der Nervenfasern anzugreifen.
Viele Nebenwirkungen wären womöglich vermeidbar
„Wenn das so wäre, würde es zur Behandlung der allermeisten Formen der MS ausreichen, künftig die Cxcl10+-Monozyten spezifisch auszuschalten, anstatt gegen die T- oder B-Zellen des Immunsystems vorzugehen“, sagt Mildner. „So würde man das Immungedächtnis des Körpers schützen und viele Nebenwirkungen der jetzigen MS-Therapien vermeiden.“ In einem nächsten Schritt möchte der Forscher gemeinsam mit seinem Team herausfinden, ob die Cxcl10+-Monozyten auch außerhalb des ZNS zu finden sind. „Wenn sie beispielsweise bereits in der Körperperipherie, zum Beispiel in den Lymphknoten, existieren“, sagt er, „wären sie dort zu therapeutischen Zwecken viel leichter angreifbar als im Gehirn.“
Text: Anke Brodmerkel
Weiterführende Informationen
- Die unabhängige Arbeitsgruppe von Alexander Mildner am MDC in der AG Leutz
- Arbeitsgruppe von Ido Amit am WIS
Fotos zum Download
- Monozyten aus dem zentralen Nervensystem trennt Alexander Mildner vom Myelin mittels Zentrifugation. Foto: Alexander Mildner, MDC
- Für die anschließende Transkriptomanalyse kontrolliert Alexander Mildner Monozyten unter dem Mikroskop. Foto: Alexander Mildner, MDC
- Einzelzellanalyse – Jede Farbe präsentiert eine Gruppe mit Monozyten, deren Transkriptome sich ähneln. Foto: Alexander Mildner, MDC
Literatur
Amir Giladi et al. (2020): „Cxcl10+ monocytes define a pathogenic subset in the central nervous system during autoimmune neuroinflammation”, Nature Immunology, DOI: 10.1038/s41590-020-0661-1
Kontakte
Dr. Alexander Mildner
Gastwissenschaftler mit DFG-Heisenberg Stipendium
Leiter einer unabhängigen Arbeitsgruppe am MDC (angegliedert an die AG „Zelldifferenzierung und Tumorigenese“ von Professor Achim Leutz)
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Christina Anders
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-2118
christina.anders@mdc-berlin.de oder presse@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.