Neuromuskuläres Organoid: Es kontrahiert!
Die Arbeitsgruppe von Dr. Mina Gouti am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz Gemeinschaft (MDC) hat funktionsfähige neuromuskuläre Organoide (NMO) entwickelt, die sich selbstständig in Rückenmarksneuronen und Muskelgewebe organisiert haben. Die beiden Zelltypen bilden gemeinsam ein komplexes neuronales Netzwerk, das Muskelgewebe kontrahieren lässt. Diese Organoide stellen Forschende in der Fachzeitschrift Cell Stem Cell vor. Sie sind ein Durchbruch im Forschungsbereich der neuromuskulären Entwicklung und Erkrankungen beim Menschen.
Fortbewegung entsteht, wenn ein komplexes neuronales Netzwerk rhythmische Muster von neuronaler Aktivität generiert. Störungen in diesem Netzwerk führen zu unheilbaren neuromuskulären Erkrankungen, Lähmung und Tod. Bislang gab es kaum verlässliche humane Zellkulturmodelle, die es erlauben Krankheiten des neuromuskulären Systems zu erforschen.
Live-Abbildung der Muskelkontraktion und der neuronalen Aktivität im neuromuskulären Organoid.
Mit einigen einzigartigen Eigenschaften sind die Organoide ein attraktives Untersuchungsmodell. Eine Schlüsseleigenschaft ist die Entwicklung der motorischen Endplatten, das sind die Verbindungsstellen zwischen Neuronen und Muskelzellen und Übertragungsort für Signale, die zu Bewegungen führen. Innerhalb der Organoide sind zum ersten Mal Rückenmarksneuronen, Skelettmuskeln und Schwann-Zellen gleichzeitig aus denselben Vorläuferzellen entstanden, sowie motorische Endplatten. Außerdem entwickelte sich ein komplexer Schaltkreis, der die Zentrale Mustergeneratoren-Schaltungen (ZMG) nachahmt, indem er oszillierende rhythmische Signale aussendet, die wesentlich für das Atmen und Laufen sind.
„Unser ursprüngliches Ziel bestand darin, die motorische Endplatte zu entwickeln. Was wir gefunden haben übertraf jedoch unsere Erwartungen – das zusätzlich ZMG-artige Netzwerke entstanden sind, ist eine aufregende, aber unerwartete Entdeckung“, sagt Gouti, Leiterin der Arbeitsgruppe „Stammzellen-Modellierung der Entwicklung und Erkrankung“. „Bisher wurde soetwas noch nicht an einem menschlichen in vitro-Modell gezeigt. Es eröffnet vollkommen neue Möglichkeiten, wie etwa die Erforschung der ZMG innerhalb von neurodegenerativen Erkrankungen.“
Die Zwei-in-eins-Herausforderung
Indem man das Potenzial von Stammzellen mit der Organoid-Technologie verknüpft, entstehen aus neuromuskulären Organoiden spannende Forschungsmodelle für Krankheiten.
Organoide sind vereinfachte organartige Strukturen in Miniaturformat, erschaffen im Labor. Herstellungstechniken aus unterschiedlichen Gewebearten wurden im letzten Jahrzehnt weiterentwickelt. Ein einzelnes Organoid, das aus zwei sich gleichzeitig entwickelnden Gewebearten besteht, blieb jedoch lange eine große Herausforderung: Um die motorische Endplatte zu erforschen, wurden beispielsweise Rückenmarksneuronen und Muskeln zunächst getrennt voneinander gezüchtet. Dann führte man sie zusammen, damit sie miteinander interagieren konnten. So haben sich zwar Verbindungen gebildet, die jedoch nur eingeschränkt funktionierten, teilweise lag das am Fehlen der essenziellen Schwann-Zellen.
„Kombiniert man einzelne Muskel- oder Neuronen-Systeme miteinander, kommt man schnell an seine Grenzen“, sagt Jorge-Miguel Faustino Martins, Erstautor und Biotechnik-Doktorand in Goutis Arbeitsgruppe. „Das ist nicht zu vergleichen mit dem was im Embryo geschieht, wo sich beides gleichzeitig entwickelt. Indem man das Potenzial von Stammzellen mit der Organoid-Technologie verknüpft, entstehen aus neuromuskulären Organoiden spannende Forschungsmodelle für Krankheiten oder für Entwicklungsstudien. So können wir die Bildung komplexer neuromuskulärer Schaltkreise in Echtzeit in einer 3D-Mikroumgebung analysieren, die jener in einem Embryo näher kommt.“
Die Wichtigkeit des richtigen Vorläuferzelltyps
Um diese Herausforderung zu meistern, machten Gouti und Kolleg*innen von einer früheren Entdeckung Gebrauch: Pluripotente humane Stammzellen in axiale Stammzellen umwandeln. Von den axialen Stammzellen ist bekannt, dass sie während der normalen Embryonalentwicklung sowohl Rückenmark als auch Skelettmuskulatur ausbilden. Der gewünschte Typ axialer Stammzellen waren in diesem Fall neuromesodermale Vorläuferzellen.
Diese Organoide kontrahierten nach 40 Tagen in der Zuchtkultur.
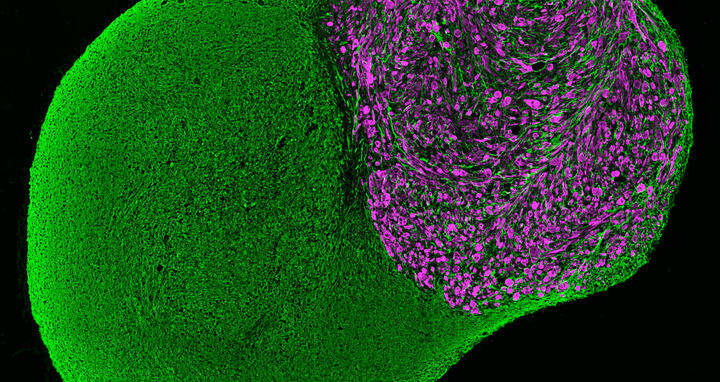
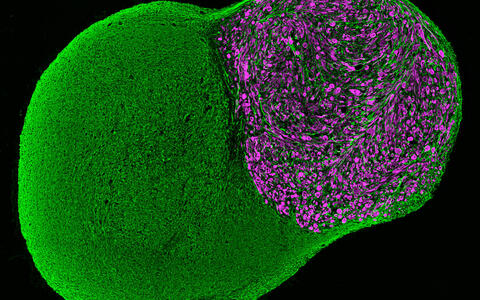
Neuromuskuläres Organoid, 100 Tage lang im Labor kultiviert, mit einem neuronalen (grün) und einem muskulären (violett) Teil.
In einer 3D-Zellkultur differenzierten sich die Stammzellen aus und organisierten sich von selbst zu komplexen Strukturen, die aus Rückenmarksneuronen und Skelettmuskelgewebe bestehen. So entwickelten sich motorische Endplatten mit terminalen Schwann-Zellen und komplexe spinale neuronale Netzwerke, ähnlich der zentralen Mustergeneratoren (ZMG).
„Auffällig ist, dass sich die beiden unterschiedlichen Gewebe in 3D selbst organisierten und funktionale Netzwerke entwickeln können“, sagt Gouti. „Diese Organoide kontrahierten nach 40 Tagen in der Zuchtkultur. Ihre Aktivität beruht nicht etwa auf spontaner Muskelaktivität, sondern auf dem Neurotransmitter Azetylcholin, der von örtlichen Motoneuronen abgesondert wird. Das wurde deutlich, als wir die Azetylcholin-Rezeptoren pharmakologisch blockierten, was die Muskelkontraktion unterband.“
Die Organoide wachsen zu einer Größe von durchschnittlich 6 Millimetern Durchmesser heran und können für etliche Monate im Labor am Leben erhalten werden, ohne dass sich ihr Zustand verschlechtert. Die gegenwärtig ältesten neuromuskulären Organoide existieren seit eineinhalb Jahren in Zuchtkultur. Wichtig ist: Analysen haben gezeigt, dass neuromuskuläre Organoide mit ähnlicher Effizienz aus unterschiedlichen menschlichen pluripotenten Stammzelllinien gebildet werden können. Dieser breite Ansatz eignet sich insbesondere für die Erforschung neuromuskulärer Erkrankungen und nutzt dabei induzierte pluripotente Stammzellen (iPS-Zellen) von Patient*innen.
Ein Modell für neuromuskuläre Erkrankungen
Das Potenzial von NMO als Forschungsmodell für neuromuskuläre Erkrankungen, testeten die Wissenschaftler*innen anhand einer Autoimmunerkrankung: Bei Myasthenia Gravis ist die Signalübertragung an der motorischen Endplatte gestört. Behandelten die Forschenden Organoide 72 Stunden lang mit dem Serum von zwei Patient*innen, führte dies zu weniger Muskelkontraktionen, was die Muskelschwäche der Erkrankten wiederspiegelt.
Dieses Ergebnis fasst Schlüsselaspekte der Krankheitssymptomatik zusammen und legt nahe, dass neuromuskuläre Organoide zuverlässig neuromuskuläre Erkrankungen modellieren können.
„Dieses Ergebnis fasst Schlüsselaspekte der Krankheitssymptomatik zusammen und legt nahe, dass neuromuskuläre Organoide zuverlässig neuromuskuläre Erkrankungen modellieren können“, so Dr. Simone Spuler, eine der Co-Autorinnen der Veröffentlichung und Leiterin der Arbeitsgruppe „Myologie“.
Die unterschiedlichen genetischen Ursachen und das variable Auftreten von lähmenden neuromuskulären Erkrankungen, wie etwa die Spinale Muskelatrophie oder Amyotrophe Lateralsklerose, waren eine große Herausforderung, um patient*innenspezifische Therapien zu entwickeln. „Die Verwendung von NMO mit iPS-Zellen von Patient*innen ermöglicht uns in Zukunft, die Entstehung und den Verlauf von Krankheiten zu untersuchen. Diese Organoide sind besser als herkömmliche geeignet, die Rolle bestimmter Zelltypen während der Bildung und Reifung der motorischen Endplatte zu erforschen – beispielsweise die der terminalen Schwannzellen bei der Entwicklung von bestimmten Krankheiten“, sagt Gouti. Zukünftige Studien werden patient*innenbasierte neuromuskuläre Organoide nutzen, um die Wirkung von unterschiedlichen Arzneimitteln festzustellen und individualisierte medizinische Ansätze zu verfolgen.
Text: Laura Petersen
Weiterführende Informationen
Downloads
Video: Live-Bildgebung von Muskelkontraktion und neuronaler Aktivität im neuromuskulären Organoid. Jorge Miguel Faustino Martins, MDC
Bild: Neuromuskuläres Organoid, 100 Tage lang im Labor kultiviert, mit einem neuronalen (grün) und einem muskulären (violett) Teil. Jorge Miguel Faustino Martins, MDC
Literatur
Faustino Martins JM et al. (2020): "Self-organizing 3D human trunk neuromuscular organoids," Cell Stem Cell, DOI: 10.1016/j.stem.2019.12.007
Kontakte
Mina Gouti
Arbeitsgruppenleiterin
Max-Delbrück-Center für Molekulare Medizin (MDC)
+49 (0)30 9406-2610
Mina.Gouti@mdc-berlin.de
Christina Anders
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Center für Molekulare Medizin (MDC)
+49 (0)30 9406 2118
christina.anders@mdc-berlin.de oder presse@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.