Experimental and Clinical Research Center
Lindenberger Weg 80
13125 Berlin
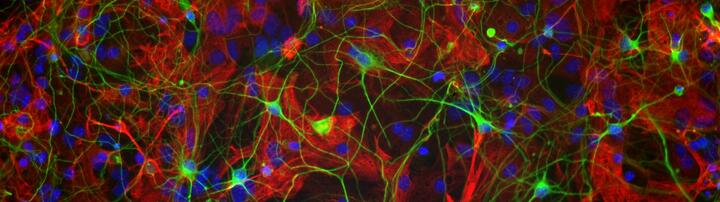
Die Behinderung bei MS steht in direktem Zusammenhang mit dem Grad der axonalen Schädigung. Es hat sich gezeigt, dass die Induktion neuroaxonaler Schäden schon früh im Krankheitsprozess vorhanden ist und Phasen der Schädigung und Reparatur kontinuierlich stattfinden.
Das Hauptziel besteht darin, die komplexen dynamischen Interaktionen von Immunzellen mit ZNS-Zellen zu verstehen. Mittels verschiedener Techniken visualisieren wir ZNS- und Immunzellen und zelluläre Effektorfunktionen, z.B. Ca2+-Dynamik oder Zytokinexpression im Tiermodell und in humanen Zellkulturmodellen.
Dies dient dazu, die aufeinanderfolgenden Schritte des Eindringens von Immunzellen und lokaler Gewebeschädigungsprozesse zu verstehen. Diese Studien werden von standardmäßigen zellularen und molekularbiologischen Analysen begleitet. Wir zielen mit unserer Arbeit darauf ab neue therapeutische Ziele zu identifizieren, die zur Verhinderung oder Regeneration von neuroaxonaler Schädigung genutzt werden können.
PD Dr. med. Volker Siffrin
Dr. Marlen Alisch (Stellvertreterin)
Dr. Jessy Chen
Charlotte Biese
CharlotteGillaLouise.Biese@mdc-berlin.de
Bakhrom Muinjonov
bakhrom.muinjonov@mdc-berlin.de
Luise Reukauf (Cand. med.)
Gesche Herold (Cand. med.)
Franziska Försterling
Tess Kühl
Jana Engelmann
Andrea Behm
Kamil Sebastian Rosiewicz
Janis Kerkering
Dr. med. Lil Antonia Meyer-Arndt
Tadhg Crowley
Eine klinisch manifeste Erstinfektion mit dem humanen B-Zell-transformierenden Epstein-Barr-Virus (EBV), welche man auch als infektiöse Mononukleose bezeichnet, stellt einen Risikofaktor dar, im späteren Leben eine MS zu entwickeln. Das EB Virus hat im Laufe der Evolution Mechanismen der Instrumentalisierung des humanen Immunsystems entwickelt, um eine optimale Ko-Existenz mit seinem humanen Wirt zu etablieren. Dadurch kommt es zu einer hohen viralen Persistenz und Durchseuchung der menschlichen Population in der gesamten Welt. Gleichzeitig hat das humane Immunsystem effiziente Mechanismen der adaptiven Immunität entwickelt, welche insbesondere auf Generierung effizienter T-Gedächtniszellen beruhen, um das Virus unter Kontrolle zu halten. Eine potentielle kausative Rolle für die Auslösung von Autoimmunerkrankungen durch die EBV-getriebene Immunreaktion wird schon länger diskutiert, konnte aber bisher nicht bewiesen werden. Wir untersuchen wie Virusproteine verändern, so dass es zu ZNS-Autoimmunität kommt. Diese Untersuchungen sind von hoher klinischer Bedeutung, da die Resultate eine spezifischere Behandlungsmöglichkeit der MS aufzeigen könnten. Aktuell ist die B-Zell-Depletion eine der effektiven Behandlungsmöglichkeiten der MS, welche als Nachteil eine starke Immunsuppression mit sich bringt. Unsere Arbeit hat das Potential eine spezifischere Behandlung der B-Zell-Funktion in der Erkrankung aufzuzeigen.
Astrozyten sind schon früh an MS beteiligt, möglicherweise sogar vor der Schädigung der Oligodendroglia, und spielen möglicherweise mehrere Rollen im Prozess der Schädigung und Reparatur von MS-Läsionen. Als Teil der Blut-Hirn-Schranke interagieren Astrozyten eindeutig mit eindringenden Immunzellen. In Tiermodellen von MS präsentieren sie den T-Lymphozyten Antigene durch MHC-Moleküle. In der weißen Substanz des ZNS sind Astrozyten für die Energieversorgung der Axon-Oligodendroglia-Einheit von größter Bedeutung. Wenn im Tiermodell der MS die Astrozyten ausgelöscht wurden, wurde eine Zunahme der Infiltrate von Immunzellen und eine Verschlimmerung der klinischen Symptome beobachtet. Andererseits wurde gezeigt, dass Astrozyten in der Lage waren, durch autokrine Glykolipid-vermittelte Astrozytenaktivierung entzündliche ZNS-Prozesse und die Entstehung neuronaler Schäden entscheidend zu verschlimmern. Daher ist die Astrozytenmodulation ein potenzieller Hebel zur Behandlung entzündlicher Neuroinflammationen. Wir analysieren Astrozyten sowohl in Tiermodellen als auch in humanen Zellkulturmodellen. Damit wollen wir therapeutische Angriffspunkte zur Verbesserung der neuroaxonalen Schadensbildung bei MS identifizieren.
Die Bewältigung der Neurodegeneration ist das ungelöste Problem in der Neurologie, nicht nur bei klassischen neurodegenerativen Erkrankungen wie der Alzheimer-Krankheit oder der Parkinson-Krankheit, sondern auch bei allen neurologischen Krankheitsbildern wie Gefäßerkrankungen (Schlaganfall), MS (entzündliche Autoimmunerkrankungen) und traumatischen Erkrankungen (z. B. Rückenmarksverletzung). In diesem Zusammenhang mehren sich Hinweise darauf, dass z.B. menschliche Astrozyten und Mikroglia einen komplexeren Funktionsumfang als jene von Versuchstierarten (meist Nagetiere) haben. Dies könnte einer der Gründe dafür sein, dass in translationalen Therapiestudien, die auf Ergebnissen in Tiermodellen basieren, bisher keine klare Strategie identifiziert werden konnte, um gezielt die neurodegenerativen Aspekte dieser Krankheiten anzugehen. Daher ist der Bedarf an In-vitro-Modellen mit vom Menschen/Patienten stammenden ZNS-Zellen offensichtlich. Wir haben Protokolle für die Differenzierung menschlicher iPSC/NSC zu Neuronen und Astrozyten sowie für die Mikroglia-Differenzierung von iPSC/HSC erstellt. Wir verwenden diese 2D-Modelle in Co-Kulturen verschiedener ZNS-abgeleiteter Zellen zur Analyse unserer Forschungsfragen. Derzeit erstellen wir 3D-Modelle, indem wir diese menschlichen Gliazellen in Gehirnschnitte von Mäusen transplantieren. Parallel dazu arbeiten wir in Zusammenarbeit mit der Stammzelleinrichtung des MDC an der Differenzierung von sogenannten Hirnorganoiden. Strukturierte und komplexere ZNS-Strukturen sind relevant, um repräsentative In-vitro-MS-Modelle zu erstellen.
Zur Zeit gibt es keine offenen Stellen in unserer Gruppe.
Studenten der Humanmedizin mit Interesse an einer medizinischen Doktorarbeit und Studenten der Naturwissenschaften mit Interesse an einer Masterarbeit können sich jedoch jederzeit bewerben.