ALS mit Organoiden und Sequenziertechnologien erforschen
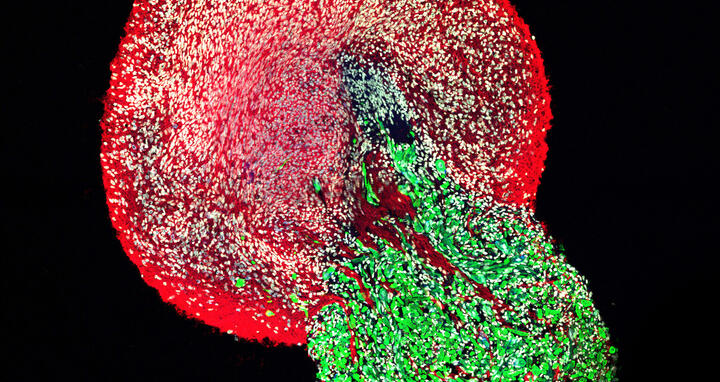
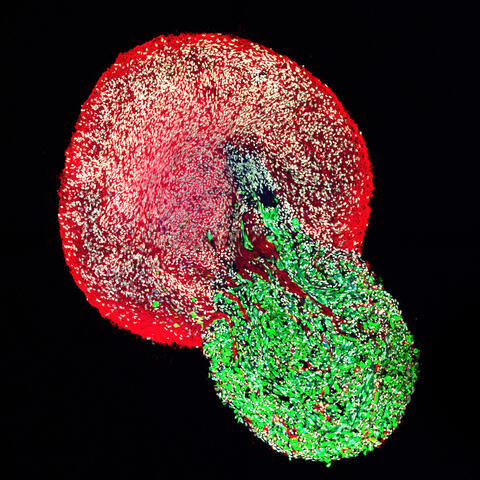
Ein Schnitt durch ein ganzes neuromuskuläres Organoid, bei dem menschliche Rückenmarksneuronen (rot) die Skelettmuskelzellen (grün) anregen. Alle Zellkerne sind weiß angefärbt.
Indem sie ihre Expertise auf dem Gebiet der neuromuskulären Organoide mit den neuesten Sequenziertechnologien kombinieren, wollen Forscher*innen am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) klären, wie Mutationen in RNA-bindenden Proteinen bei ALS-Patient*innen zum Absterben von Motoneuronen führen. Dieses gemeinsame Unterfangen kommt dank der Chan Zuckerberg Initiative (CZI) zustande, die Dr. Mina Gouti und Professor Nikolaus Rajewsky mit dem Collaborative Pairs Pilot Project Award auszeichnet, einem Zuschuss für neue, interdisziplinäre Kooperationen. Gemeinsam wollen sie sich ein detailliertes Bild davon machen, wie sich Mutationen auf die RNA-Verarbeitung auswirken und welchen Einfluss dies auf den Verlauf von ALS hat.
„Wir werden sehen, wo die Krankheit ihren Anfang nimmt, also welche Zellpopulation zuerst betroffen ist – sind es die Motoneuronen oder ist es die Skelettmuskulatur?“, sagt Gouti, Leiterin der Arbeitsgruppe „Stammzell-Modellierung der Entwicklung und Erkrankung“.
Keine Zeit zu verlieren
Wenn Motoneuronen absterben, ist das irreversibel. Wir müssen einen Weg finden, diese Patient*innen zu behandeln, bevor die Motoneuronen absterben.
ALS ist eine unheilbare, schnell voranschreitende und komplexe Krankheit. Wenn die Motoneuronen absterben, verschlechtern sich die Verbindungen zur Skelettmuskulatur. Nach und nach verlieren die Patient*innen die Koordination ihrer Muskeln, die Fähigkeit, ihre Gliedmaßen zu bewegen und letztlich zu atmen. Zwar werden verschiedene genetische Mutationen mit ALS in Verbindung gebracht, die genauen Schritte, die zum Absterben von Motoneuronen führen, sind indes unklar. Würde man diesen Prozess verstehen, könnte man potenzielle Angriffspunkte für Therapien und Behandlungen identifizieren.
„Wenn Motoneuronen absterben, ist das irreversibel“, sagt Nikolaus Rajewsky, Leiter der Arbeitsgruppe Systembiologie von Gen-regulatorischen Elementen und wissenschaftlicher Direktor des Berlin Institute for Medical Systems Biology (BIMSB) des MDC. „Wir müssen einen Weg finden, diese Patient*innen zu behandeln, bevor die Motoneuronen absterben.“
Neue Technologien
Mit Zellen von ALS-Patient*innen werden Gouti und ihr Team 3D-Organoide kultivieren, also organähnliche Strukturen im Miniaturformat. Sie haben vor Kurzem ein Verfahren entwickelt, mit dem sie extrem weit entwickelte und funktionsfähige neuromuskuläre Organoide erzeugen können. Sie enthalten alle kritischen Zelltypen, die gemeinsam neuromuskuläre Netzwerke bilden. Bei diesen Organoiden bringen Motoneuronen die Muskeln dazu zu kontrahieren, genau wie im menschlichen Körper. Die Forscher*innen werden Organoide mit und ohne die ALS-Mutationen züchten.
Menschliche neuromuskuläre Organoide, die mehrere Monate in einer 3D-Kultur gewachsen sind.
Der genetische Hintergrund ist ansonsten völlig identisch. Die Organoide sind ein zuverlässiges Zellkultur-Modell, das es den Wissenschaftler*innen ermöglicht, bereits den Beginn der Krankheit zu beobachten. Bei menschlichen Patientinnen und Patienten ist das nicht möglich, da ALS oft erst sehr spät diagnostiziert wird.
Rajewsky und seine Arbeitsgruppe werden diese Organoid-Gewebeproben in verschiedenen Entwicklungsstadien sequenzieren, um den Abläufen auf RNA-Ebene auf den Grund zu gehen. Die Hauptaufgabe von RNA ist die Umwandlung von DNA in Proteine. Mutationen der RNA können daher manchmal funktionsunfähige oder sogar schädliche Proteine zur Folge haben. Das Interesse der Forscher*innen richtet sich insbesondere auf RNA-Mutationen oder Proteine, die mit mysteriösen Verklumpungen im Inneren des Zellkerns in Zusammenhang stehen. Sie wollen herausfinden, ob diese Paraspeckles genannten Erscheinungen in irgendeiner Art für das Absterben von Motoneuronen verantwortlich sind.
Die Arbeitsgruppe von Rajewsky ist auf die neuesten Sequenzierungstechnologien spezialisiert. Bei diesem Projekt kommen drei Verfahren zum Einsatz: Long-Read-Sequenzierung, bei der die gesamte im Organoid befindliche RNA aufgeschlüsselt wird, Einzelzell-RNA-Sequenzierung, bei der die RNA genau den Zelltypen zugeordnet wird, die sie exprimiert – etwa einer Zelle der Skelettmuskulatur oder einem Motoneuron, und räumliche Transkriptomik, die Aufschluss darüber gibt, wo sich Zellen und RNA im Organoid befinden. Die Kombination dieser unterschiedlichen Verfahren liefert ein detailliertes Bild der RNA-Aktivität in Raum und Zeit.
„Jede der Technologien wurde einzeln validiert. Die Herausforderung besteht jetzt darin, diese zielführend zu kombinieren“, sagt Dr. David Koppstein, Postdoktorand in der Arbeitsgruppe von Rajewsky und einer der Projektplaner.
Ein wissenschaftliches Netzwerk
Wenn man Lösungen für derart schwere, folgenschwere Krankheiten finden will, müssen Expertinnen und Experten aus vielen verschiedenen Fachbereichen an einem Strang ziehen und ihr Wissen miteinander teilen.
Die Chan Zuckerberg Initiative wurde von Dr. Priscilla Chan und ihrem Ehemann, Facebook-CEO Mark Zuckerberg, ins Leben gerufen und setzt sich für die Unterstützung von Wissenschaft und Technologie ein. Ihr Ziel ist es, dass bis zum Jahr 2100 sämtliche Krankheiten geheilt, verhindert oder bewältigt werden können. Das CZI Neurodegeneration Challenge Network will insbesondere das Wissen über die Neurodegeneration voranbringen, mit neuen Ideen, Verfahren und Talenten sowie einer weltweiten interdisziplinären Zusammenarbeit.
Die vom Netzwerk verliehenen Collaborative Pairs Pilot Project Awards sind mit 150.000 US-Dollar dotiert und werden an Teams mit je zwei Principle Investigators (PIs) vergeben. Weitere Bedingungen: Eine*r PI muss sich am Anfang oder in der Mitte seiner Forscher*innenlaufbahn befinden, und das Team darf in der Vergangenheit keine Förderung für ein gemeinsames Projekt erhalten haben. In dieser Runde werden bis zu 30 Teams durch die Initiative gefördert. Nach dem ersten Jahr erhalten erfolgreiche Teams die Chance auf eine zweite Förderphase, bei der jedes ausgewählte Team mit 1,6 Mio. US-Dollar über vier Jahre unterstützt wird.
„Wenn man Lösungen für derart schwere, folgenschwere Krankheiten finden will, müssen Expertinnen und Experten aus vielen verschiedenen Fachbereichen an einem Strang ziehen und ihr Wissen miteinander teilen“, sagt Gouti. „Wir freuen uns auf diese neue Kooperation und die Arbeit mit anderen Beteiligten im CZI-Netzwerk.“
Text: Laura Petersen
Weiterführende Informationen
- Pressemitteilung: Neuromuskuläres Organoid: Es kontrahiert!
- CZI-Pressemitteilung (engl.): CZI Awards $4.5M to Advance Innovative Approaches to Fighting Neurodegenerative Diseases
- CZI-Webseite der geförderten Projekte (engl.)
- CZI-Artikel auf Medium (engl.): “Supporting Bold and Transformative Ideas in Neurodegeneration”
Medien zum Download
Ein Schnitt durch ein ganzes neuromuskuläres Organoid, bei dem menschliche Rückenmarksneuronen (rot) die Skelettmuskelzellen (grün) anregen. Alle Zellkerne sind weiß angefärbt. Foto: Jorge Miguel Faustino Martins, Gouti Lab, MDC
Live-Bildgebung von Muskelkontraktion und neuronaler Aktivität im neuromuskulären Organoid. Video: Jorge Miguel Faustino Martins, Gouti Lab, MDC
Menschliche neuromuskuläre Organoide, die mehrere Monate in einer 3D-Kultur gewachsen sind. Foto: Anyess von Bock / MDC
Kontakte
Dr. Mina Gouti
Leiterin der Arbeitsgruppe „Stammzell-Modellierung der Entwicklung und Erkrankung
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 (0)30 9406-2610
Mina.Gouti@mdc-berlin.de
Prof. Dr. Nikolaus Rajewsky
Leiter der Arbeitsgruppe „Systembiologie von Gen-regulatorischen Elementen“
Direktor des Berliner Instituts für Medizinische Systembiologie (BIMSB)
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 (0)30 9406-2999 (Büro)
rajewsky@mdc-berlin.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 (0)30 9406-2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Über die Chan Zuckerberg Initiative
-
-
Die 2015 von Dr. Priscilla Chan und Mark Zuckerberg gegründete „Chan Zuckerberg Initiative“ (CZI) ist eine neue Art von Philanthropie. Sie nutzt Technologien, um einige der größten Herausforderungen der Welt zu lösen – wie Krankheiten zu bekämpfen, die Bildung zu verbessern und das Strafrechtssystem zu reformieren. In den drei Kernbereichen der Initiative, Wissenschaft, Bildung sowie Justiz und Chancen, verbindet CZI Technik mit Fördermitteln, wirkungsorientierten Investitionen sowie Politik- und Lobbyarbeit, um eine integrative, gerechte und gesunde Zukunft für alle aufzubauen. Weitere Informationen gibt es unter www.chanzuckerberg.com.
- Das Max-Delbrück-Centrum für Molekulare Medizin
-
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) wurde 1992 in Berlin gegründet. Es ist nach dem deutsch-amerikanischen Physiker Max Delbrück benannt, dem 1969 der Nobelpreis für Physiologie und Medizin verliehen wurde. Aufgabe des MDC ist die Erforschung molekularer Mechanismen, um die Ursachen von Krankheiten zu verstehen und sie besser zu diagnostizieren, verhüten und wirksam bekämpfen zu können. Dabei kooperiert das MDC mit der Charité – Universitätsmedizin Berlin und dem Berlin Institute of Health (BIH) sowie mit nationalen Partnern, z.B. dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DHZK), und zahlreichen internationalen Forschungseinrichtungen. Am MDC arbeiten mehr als 1.600 Beschäftigte und Gäste aus nahezu 60 Ländern; davon sind fast 1.300 in der Wissenschaft tätig. Es wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Berlin finanziert und ist Mitglied in der Helmholtz-Gemeinschaft deutscher Forschungszentren. www.mdc-berlin.de