Neue Muskeln für die Blase
Über 8000 verschiedene Seltene Erkrankungen sind bekannt, über 30 Millionen Menschen sind allein in Europa betroffen. Therapien für diese meist noch nicht behandelbaren Krankheiten zu entwickeln, ist eine wichtige gesellschaftliche Aufgabe und damit eine Herausforderung für die Forschung. Die Epispadie ist eine davon. Hier führt eine vorgeburtliche Entwicklungsstörung zu einer abnormalen Lage und Spaltbildung der Harnröhre und einem unvollständig ausgebildeten Blasenschließmuskel.
Nur etwa sieben Jungen und noch weniger Mädchen werden jedes Jahr in Deutschland mit dieser Besonderheit geboren. Sie ist mit einem hohen Leidensdruck verbunden: Denn die äußerlich sichtbare Fehlbildung kann man mit einer Operation beheben, das gelingt aber leider beim Blasenschließmuskel nicht so einfach. „Daher sind diese Kinder oft lebenslang inkontinent, was mit einer hohen psychologischen Belastung für die Betroffenen und deren Familien einhergeht“, erklärt Professorin Simone Spuler vom Experimental and Clinical Research Center (ECRC), einer gemeinsamen Einrichtung der Charité – Universitätsmedizin Berlin und des Max-Delbrück-Centrums für molekulare Medizin in der Helmholtz-Gemeinschaft (MDC). Sie ist Spezialistin für Stammzell- und Muskelforschung. „Wir haben deshalb überlegt, wie wir ihnen mit unserer Expertise helfen können.“
Das Bundesforschungsministerium (BMBF) fördert die Studie mit rund 3,3 Millionen Euro. Das Berlin Institute of Health (BIH) in der Charité hat das Vorhaben mit seinem Spark-BIH-Programm auf dem Weg vom Labor in die Klinik mit einer Million Euro unterstützt.
Muskelstammzellen bilden neuen Schließmuskel
Die Wissenschaftler*innen um Simone Spuler hatten eine Methode entwickelt, mit der sie regenerationsfähige Muskelstammzellen aus Muskelgewebe isolieren können. „Wir nehmen eine Gewebeprobe, eine Biopsie, aus dem Oberschenkel und isolieren daraus Muskelstammzellen. Diese vermehren wir anschließend auf ein Vielfaches und spritzen sie direkt an in die Defektstelle des Blasenschließmuskels.“ Bei Ratten führte das tatsächlich dazu, dass sich ein neuer Schließmuskel bildete, der auch funktionstüchtig war. Da deren verändertes Immunsystem menschliche Zellen tolerierte, gelang dies auch mit menschlichen Muskelstammzellen.
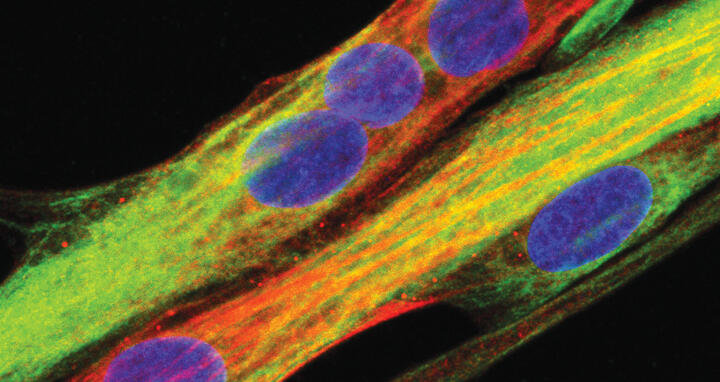
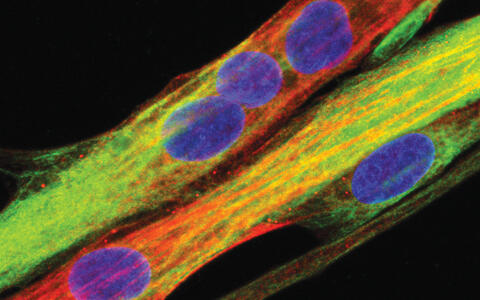
Menschliche Muskelzelle, wie sie aus Muskelstammzellen differenziert. (Blau: Zellkern, grün: Desmin, rot: Myosin Heavy Chain)
„Doch trotz dieser ermutigenden Ergebnisse konnten wir nicht sofort eine klinische Studie mit Betroffenen beginnen“, sagt die Medizinerin. „Denn die Vorschriften sind streng. Nur Zellen, die in einem pharmazeutischen Herstellungsverfahren, der „good manufacturing practice“ oder kurz GMP, produziert werden, dürfen im Menschen angewandt werden. Dieses Verfahren aufzusetzen, ist sehr anspruchsvoll.“ Die unter GMP-Bedingungen hergestellten Zellen werden für die präklinischen Sicherheitsprüfungen zunächst im Tiermodell eingesetzt.
Unterstützung aus den USA – und vom BIH
Die Auflagen der Zulassungsbehörden, in Deutschland das Paul-Ehrlich-Institut, verlangen, dass nur speziell dafür akkreditierte Labore die Tierversuche für eine klinische Studie durchführen dürfen. Der Fachbegriff ist „good laboratory practice“, GLP-Bedingungen. Auf der Suche nach einem GLP-Labor, das gleichzeitig über mikrochirurgische Fähigkeiten verfügte, mit denen sich die Muskelstammzellen in den Blasenschließmuskel von Ratten übertragen lassen, wurden die Wissenschaftler*innen in den USA fündig: „Ungefähr 300 Kilometer östlich von Chicago, mitten in Michigan, gab es ein solches Labor“, berichtet Simone Spuler. „Um den dortigen Kollegen genau zu erklären, was wir planen, mussten wir mehrmals in die USA reisen. Die Vorbereitungen, die erforderliche Einarbeitungszeit und die Durchführung der Versuche waren unglaublich zeit- und kostenintensiv. Das hätten wir ohne die Unterstützung durch das BIH-Spark-Programm nicht geschafft!“
Eine Million Euro stellte das BIH den Muskelforscher*innen um Simone Spuler zur Verfügung. „Genau dies ist unser Anliegen“, erklärt Professor Christopher Baum, Vorsitzender des BIH-Direktoriums und Vorstand für den Translationsforschungsbereich der Charité. „Wir wollen Wissenschaftler*innen dabei unterstützen, ihre Ergebnisse aus dem Labor zu den Patientinnen und Patienten zu bringen und damit die medizinische Translation fördern. Damit erreichen wir, dass aus Forschung Gesundheit wird.“ Dr. Tanja Rosenmund, die Leiterin des BIH-Spark-Programms freut sich ebenfalls. „Das Projekt für die Epispadie ist deshalb so spannend, weil es – falls es gelingt – viele weitere Möglichkeiten eröffnet: Inkontinenz ist ja ein weit verbreitetes Problem und Muskelschwäche ohnehin. Wir hoffen deshalb, mit dieser Förderung möglichst vielen weiteren Studien den Weg zu ebnen.“
Klinische Studie mit 21 Jungen
Nachdem die Ergebnisse in den USA gezeigt hatten, dass die transplantierten Muskelstammzellen die Inkontinenz bei den Ratten beheben konnte und die Sicherheit des Zellproduktes bestmöglich bestätigt werden konnte, steht nun der klinischen Studie nichts mehr im Weg: 21 betroffene Jungen im Alter zwischen drei und siebzehn Jahren sollen an den Universitätskliniken Ulm und Regensburg behandelt werden. Dort leiten Professorin Anne-Karoline Ebert und Professor Wolfgang Rösch die Zentren für den Blasenekstrophie-Epispadie-Komplex. Die Studie ist Placebo-kontrolliert, randomisiert und doppelt-verblindet geplant. Das bedeutet, dass zufällig ausgewählte fünf der 21 Jungen ein Placebo (Kochsalzlösung) statt ihrer eigenen Muskelstammzellen erhalten. Weder Ärzt*innen noch Patient*innen wissen bis zum Ende der Studie, wer diese fünf waren. „Das müssen wir tun, um wissenschaftlich gesicherte Ergebnisse zu erhalten“, erklärt Simone Spuler. „Wenn sich nach der Datenanalyse zeigt, dass es den Kindern nach der Zellinjektion besser geht als denen, die das Placebo erhalten haben, besteht natürlich die Möglichkeit, die Zellinjektion nachzuholen. Das ist möglich, da sich die isolierten Muskelstammzellen problemlos tiefgekühlt aufbewahren lassen.“
Das Bundesforschungsministerium war so überzeugt von dem Antrag aus Berlin, dass es 3,3 Millionen Euro für die Durchführung der Klinischen Studie zur Verfügung gestellt hat. In wenigen Monaten soll der erste Patient behandelt werden.
Text: Stephanie Seltmann, BIH
Bild zum Download
Menschliche Muskelzelle, wie sie aus Muskelstammzellen differenziert. (Blau: Zellkern, grün: Desmin, rot: Myosin Heavy Chain).
Foto: by courtesy from the American Society for Clinical Investigation; https://insight.jci.org
Kontakte
Dr. Stefanie Seltmann
Leiterin Stabsstelle Kommunikation BIH
Berlin Institute of Health in der Charité (BIH)
+49-30-450-543019
stefanie.seltmann@bih-charite.de
Jutta Kramm
Leiterin Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-2140
jutta.kramm@mdc-berlin.de oder presse@mdc-berlin.de
- Berlin Institute of Health in der Charité (BIH)
-
-
Die Mission des Berlin Institute of Health (BIH) ist die medizinische Translation: Erkenntnisse aus der biomedizinischen Forschung werden in neue Ansätze zur personalisierten Vorhersage, Prävention, Diagnostik und Therapie übertragen, umgekehrt führen Beobachtungen im klinischen Alltag zu neuen Forschungsideen. Ziel ist es, einen relevanten medizinischen Nutzen für Patient*innen und Bürger*innen zu erreichen. Dazu etabliert das BIH als Translationsforschungsbereich in der Charité ein umfassendes translationales Ökosystem, setzt auf ein organübergreifendes Verständnis von Gesundheit und Krankheit und fördert einen translationalen Kulturwandel in der biomedizinischen Forschung. Das BIH wurde 2013 gegründet und wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung (BMBF) und zu zehn Prozent vom Land Berlin gefördert. Die Gründungsinstitutionen Charité – Universitätsmedizin Berlin und Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) waren bis 2020 eigenständige Gliedkörperschaften im BIH. Seit 2021 ist das BIH als so genannte dritte Säule in die Charité integriert, das MDC ist Privilegierter Partner des BIH.
- Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.