Nur scheinbar gesund: Wie sich Titin-Mutationen auf das Herz auswirken
Ein internationales Konsortium unter Beteiligung der MDC-Forschungsgruppe von Norbert Hübner hat herausgefunden, dass Mutationen des Titin-Gens bislang unbekannte Auswirkungen auf die Herzfunktionen gesunder Menschen haben. Diese Mutationen betreffen einen von 100 Menschen. Die Ergebnisse wurden jüngst in der renommierten Fachzeitschrift Nature Genetics veröffentlicht. An der großangelegten Untersuchung waren Forscherteams aus London, Singapur und vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) beteiligt; das MDC-Team hat sich vor allem mit den molekularen Analysen beschäftigt. Der Blick auf Gen, Transkription und Translation zeigt, welche Mechanismen auf molekularer Ebene dazu führen, dass ein eigentlich gesundes Herz in seiner Funktion beeinträchtigt wird – eine potenzielle „Zeitbombe“, die in einem von hundert Menschen weltweit schlummern könnte und mittels weiterer Stressfaktoren zu Herzversagen führen kann.
Titin, das größte Protein im menschlichen Körper, hat eine zentrale Funktion im Muskelgewebe inne. Es arbeitet wie eine Sprungfeder und hält die Herzmuskeln zusammen, wenn sie sich zusammenziehen und entspannen. Variiert die Länge dieser molekularen Feder, ändern sich die mechanischen Eigenschaften des Muskels; er wird zum Beispiel steifer, oder das Herz dehnt sich zu stark aus und kann weniger kraftvoll pumpen.
Bestimmte Mutationen im Titin-Gen führen dazu, dass 50 Prozent aller Titin-Proteine eines Herzens nicht vollständig produziert werden können und deshalb für das Herz unbrauchbar sind. Diese TTNtv (Titin truncating variants) genannten Mutationen kommen bei 25 Prozent aller Patienten vor, die unter erblich bedingter dilatativer Kardiomyopathie (DCM) leiden. Das ist eine erbliche Herzmuskelschwächekrankheit, die zum Herzversagen und plötzlichem Tod führen kann.
Zwei gezielte Mutationen im Titin-Gen
Aber auch viele gesunde Menschen tragen diese Mutationen in sich, sie sind in der Bevölkerung weit verbreitet. Damit ist unklar, ob TTNtv stets negative Auswirkungen auf das Herz haben. Warum sind die meisten betroffenen Menschen gesund – oder hat die Mutation vielleicht doch Folgen? Dieser Frage ging die Untersuchung auf den Grund.
Das Team vom MDC trug einen entscheidenden Baustein zu deren Lösung bei. Es untersuchte zwei Rattenmodelle auf molekularer Ebene: „Die Tiere waren genetisch vollkommen identisch, bis auf eine einzige, gezielt gesetzte Mutation im Titin-Gen, die jedoch bei beiden Modellen an jeweils unterschiedlicher Stelle lag“, berichtet Sebastiaan van Heesch. Er ist Wissenschaftler in der MDC-Arbeitsgruppe von Norbert Hübner, aus der mehrere Forschende an dem Projekt beteiligt waren.
Das Herz muss seinen Energiestoffwechsel anpassen
„Alle Tiere in unserer Untersuchung schienen gesund zu sein, sie wiesen jedoch molekulare Merkmale auf, die wir auch in den Herzen der an DCM erkrankten Personen fanden“, sagt der Forscher. Zu diesen Merkmalen gehört die Produktion längerer Titin-Isoformen, die es dem Herzen erlauben, sich zu verformen, sowie die fortlaufende Produktion und anschließende Entsorgung von mutierter Titin-RNA und mutierten Titin-Proteinen. „Diese Prozesse kosten das Herz eine beachtliche Menge Energie. Wir konnten auch auf molekularer Ebene zeigen, dass es seinen Energiestoffwechsel anpassen muss, um weiterhin angemessen zu funktionieren“, erklärt van Heesch. Die Änderungen im Energiehaushalt wurden anschließend vom Team in Singapur bestätigt, das ebenfalls beobachtete, dass die zunächst gesund erscheinenden Rattenherzen nicht korrekt kontrahieren konnten, als sie gezieltem Stress ausgesetzt wurden.
Eleonora Adami, die ebenfalls im Projekt arbeitete, ergänzt: „Insgesamt scheint das Herz in einem permanenten Kompensationszustand zu sein, um die Fehler zu korrigieren, die von den Titin-Mutationen ausgelöst werden. Wenn das Herz zusätzlichem Stress ausgesetzt wird, könnte dies ein Auslöser für Herzversagen sein“.
Um zu sehen, was dabei genau mit den mutierten Titin-Molekülen passiert, analysierten die MDC-Forschenden die Vorgänge auf der Ebene der Translation, also der Proteinherstellung durch die Ribosomen. Eleonora Adami hat ein spezielles Verfahren optimiert, mit dem ribosomale Aktivität direkt im Gewebe des Herzens gemessen werden kann. Dabei werden nur jene Teile der RNA sequenziert, an denen die Ribosomen sitzen. „Wir können mit dieser Technik die tatsächliche Translation der mutierten Gene visualisieren“, berichtet die Forscherin. Sie beobachtete, wie die Ribosomen die RNA-Botschaft in Titin-Proteine umwandeln, die teilweise verkürzt sind.
Die Zellen müssen „nutzlose“ Titin-Proteine abbauen
„Dass nicht alle mutierten Titin-RNA-Moleküle abgebaut werden und manche in der verkürzten Variante übertragen werden, konnten wir erstmals nachweisen. Da diese Varianten für die Zelle nutzlos sind, müssen sie abgebaut werden, und das kostet die Zelle viel Energie“, sagt Adami. „Damit wird dem Herzen mitgeteilt: Du musst etwas tun, um dich gesundzuhalten, und dafür zusätzliche Energie aufbringen – ein weiterer Stressfaktor für das Herz“, ergänzt van Heesch.
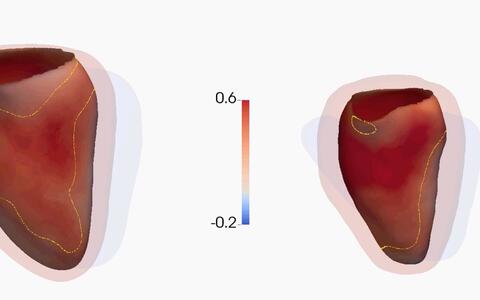
Die Ergebnisse wurden mit den Daten von 2.495 DCM-Erkrankten abgeglichen. Um die Effekte von TTNtv auf das Herz zu bestimmen, sequenzierte das Team zusätzlich die Gene von weiteren 1.409 gesunden Personen, deren Herzen zudem per Magnetresonanztherapie untersucht wurden. Auf physiologischer Ebene führen die von den Titin-Mutationen ausgelösten Veränderungen insgesamt dazu, dass der Herzmuskel schwächer ist; so zeigte sich auch an den MRT-Analysen, dass die nicht erkrankten Probanden mit Mutation leicht vergrößerte – wenn auch noch gesunde – Herzen hatten.
Potenzieller Nutzen für Herz-Screenings
In der Studie konnten die MDC-Forschenden zu einem besseren Verständnis darüber beitragen, welches krankmachende Potenzial die Titin-Mutation birgt, und zwar auf unterschiedlichen molekularen Ebenen der Genexpression, also jenem Vorgang, bei dem die genetische Information umgesetzt und für Zelle und Körper nutzbar gemacht wird. „Auf der ganzen Welt leben Millionen von Menschen mit dieser Mutation, die gesund scheinen, aber deren Herzen eines Tages versagen könnten. Was wir herausgefunden haben, könnte zukünftig für Screenings genutzt werden, um Menschen zu identifizieren, die ein erhöhtes Risiko haben, Herzprobleme zu entwickeln“, fasst Eleonora Adami zusammen.
Welche Faktoren bei Menschen mit Titin-Mutation krankheitsauslösend sein können, ist noch unbekannt. Auslöser könnten zusätzliche genetische Faktoren sein, oder Umwelteinflüsse wie Alkohol oder Extremsport könnten ein besonderes Risiko für Herzversagen mit sich bringen – spannende Fragen für weitere Untersuchungen.
Sebastian Schafer1,2,17, Antonio de Marvao3,17, Eleonora Adami4, Lorna R Fiedler2, Benjamin Ng1, Ester Khin2, Owen J L Rackham2, Sebastiaan van Heesch4, Chee J Pua1, Miao Kui2, Roddy Walsh5, Upasana Tayal5, Sanjay K Prasad5, Timothy J W Dawes3, Nicole S J Ko2, David Sim1, Laura L H Chan1, Calvin W L Chin1,2, Francesco Mazzarotto5, Paul J Barton5, Franziska Kreuchwig4, Dominique P V de Kleijn6,7, Teresa Totman6, Carlo Biffi3, Nicole Tee1, Daniel Rueckert8, Valentin Schneider4, Allison Faber4, Vera Regitz-Zagrosek9,10, Jonathan G Seidman11, Christine E Seidman11–13, Wolfgang A Linke14,15, Jean-Paul Kovalik2, Declan O’Regan3, James S Ware3,5,18, Norbert Hubner4,10,16,18 & Stuart A Cook1,2,5,18 (2016): „Titin-truncating variants affect heart function in disease cohorts and the general population“ Nature Genetics. doi:10.1038/ng.3719
1National Heart Centre Singapore, Singapore. 2Duke–National University of Singapore, Singapore. 3Cardiovascular and Metabolic Disorders Program, MRC Clinical Sciences Centre, Faculty of Medicine, Imperial College London, Hammersmith Hospital Campus, London, UK. 4Cardiovascular and Metabolic Sciences, Max Delbrück Center for Molecular Medicine in the Helmholtz Association (MDC), Berlin, Germany. 5National Heart and Lung Institute and NIHR Royal Brompton Cardiovascular BRU, Imperial College London, London, UK. 6Department of Surgery, National University of Singapore, Singapore. 7Departments of Cardiology and Vascular Surgery, University Medical Center, Utrecht, the Netherlands. 8Department of Computing, Imperial College London, London, UK. 9Institute of Gender in Medicine, Charité Universitätsmedizin Berlin, Berlin, Germany. 10DZHK (German Centre for Cardiovascular Research), partner site Berlin, Berlin, Germany. 11Department of Genetics, Harvard Medical School, Boston, Massachusetts, USA. 12Division of Cardiovascular Medicine, Brigham and Women’s Hospital, Boston, Massachusetts, USA. 13Howard Hughes Medical Institute, Chevy Chase, Maryland, USA. 14Department of Cardiovascular Physiology, Ruhr University Bochum, Bochum, Germany. 15DZHK (German Centre for Cardiovascular Research), partner site Goettingen, Goettingen, Germany. 16Charité Universitätsmedizin, Berlin, Germany. 17These authors contributed equally to this work. 18These authors jointly supervised this work