Die Gene des sechsten Sinns
Menschen ohne Propriozeption sind zu keiner wirklich gezielten Bewegung fähig.
Sehen, hören, riechen, schmecken, fühlen – mit diesen fünf Sinnen, die wohl jedem von uns geläufig sind, nehmen wir Menschen unsere Umwelt wahr. Ähnlich wichtig, aber weit weniger bekannt, ist der sechste Sinn. „Seine Aufgabe ist es, Informationen aus den Muskeln und Gelenken über Bewegungen sowie die Haltung und Position unseres Körpers im Raum zu sammeln und an das zentrale Nervensystem weiterzuleiten“, erklärt Dr. Niccolò Zampieri, Leiter der Arbeitsgruppe „Entwicklung und Funktion neuraler Netzwerke“ am Berliner Max Delbrück Center. „Nur mithilfe dieser Propriozeption genannten Fähigkeit ist es dem zentralen Nervensystem möglich, unseren Muskeln über die Motoneurone für eine bestimmte Bewegung die richtigen Signale zu senden.“
Dem sechsten Sinn, der anders als die restlichen fünf Sinne völlig unbewusst abläuft, ist es somit zu verdanken, dass wir nachts, selbst wenn es völlig dunkel ist, nicht hinfallen oder die Tasse Kaffee am Morgen auch mit geschlossenen Augen zum Mund führen können. Doch nicht nur das: „Menschen ohne Propriozeption sind zu keiner wirklich gezielten Bewegung fähig“, erläutert Zampieri. Im Fachblatt „Nature Communications“ beschreiben er und sein Team jetzt molekulare Marker der am sechsten Sinn beteiligten Zellen. Sie sollen dabei helfen, die Funktionen dieser propriozeptiven sensorischen Neurone, kurz pSN, künftig noch besser zu verstehen.
Ohne präzise Verbindungen geht es nicht
Lokalisiert sind die Zellkörper der pSN in den Spinalganglien des Rückenmarks. Über ihre langen Nervenfasern sind sie mit den Muskelspindeln und Golgi-Sehnenorganen verbunden, die permanent die Dehnung und die Spannung aller Muskeln im Körper erfassen. Die pSN senden diese Informationen an das zentrale Nervensystem, wo sie genutzt werden, um die Aktivität der Motoneurone zu steuern und somit zielgerichtete Bewegungen zu ermöglichen.
„Eine Grundvoraussetzung dafür ist, dass die pSN präzise mit den verschiedenen Muskeln unseres Körpers verbunden sind“, sagt Dr. Stephan Dietrich aus Zampieris Arbeitsgruppe. Molekulare Programme, die solch exakte Verknüpfungen gewährleisten und den muskelspezifischen pSN ihre ganz eigene Identität verleihen, waren bislang jedoch weitgehend unbekannt. „In unserer Studie haben wir daher nach molekularen Markern gesucht, durch die sich die pSN der Bauch-, Rücken- und Beinmuskulatur bei Mäusen voneinander unterscheiden“, erläutert Dietrich, der Erstautor der am Max Delbrück Center vorgenommenen Arbeit ist.
Wachsenden Nervenfasern den Weg weisen
Mithilfe der Einzelzell-Sequenzierung untersuchte das Team, welche Gene in den pSN der Bauch-, Rücken- und Beinmuskulatur jeweils abgelesen und in RNA übersetzt werden. „Tatsächlich konnten wir für die pSN der unterschiedlichen Muskelgruppen charakteristische Gene identifizieren“, berichtet Dietrich. „Außerdem haben wir gezeigt, dass diese Erbanlagen bereits im Embryonalstadium aktiv sind und auch nach der Geburt zumindest noch eine Zeit lang angeschaltet bleiben.“ Es gebe also festgelegte genetische Programme dafür, dass bestimmte Propriozeptoren entweder die Bauch-, Rücken- oder Beinmuskulatur ansteuern, sagt Dietrich.
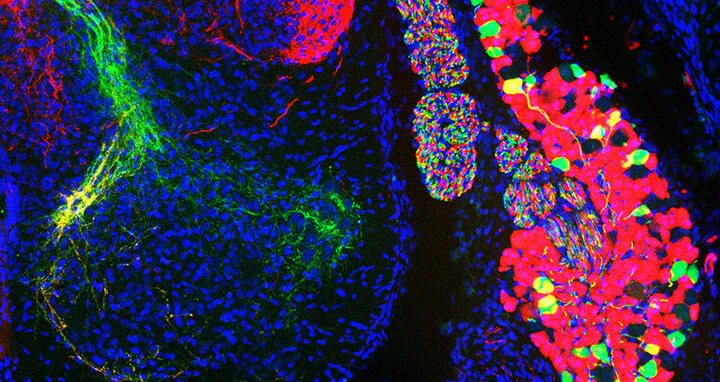
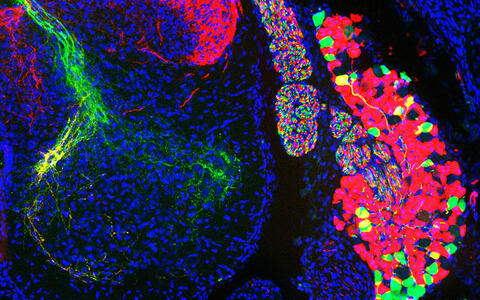
Zellpopulationen von sensorischen Neuronen in einem Spinalganglion des Rückenmarks (rechts) und ihre Axone im Rückenmark (links): Die Zellen, die grün dargestellt sind, erfassen propriozeptive Informationen; die rot angefärbten Zellen in Rot Wärme und Berührung.
Gefunden haben die Berliner Forschenden unter anderem mehrere Gene für Ephrine und deren Rezeptoren. „Von diesen Proteinen weiß man, dass sie daran beteiligt sind, wachsenden Nervenfasern im sich entwickelnden Nervensystem den richtigen Weg zu weisen“, erklärt Dietrich. In Mäusen, die das Ephrin A5 nicht herstellen können, beobachtete das Team, dass bei diesen Tieren die Verbindungen zwischen den Propriozeptoren und der hinteren Beinmuskulatur beeinträchtigt sind.
Ein Ziel sind bessere Neuroprothesen
„Die in unserer Arbeit identifizierten Marker sollen nun helfen, die Entwicklung und Funktion von individuellen muskelspezifischen sensorischen Netzwerken weiter zu erforschen“, sagt Dietrich. „Mit den Methoden der Optogenetik zum Beispiel können wir Propriozeptoren per Licht entweder einzeln oder als Gruppe gezielt an- und ausschalten – so dass ihre konkrete Aufgabe beim sechsten Sinn ersichtlich wird“, ergänzt Zampieri.
In Zukunft solle das neu gewonnene Wissen zum Beispiel Patient*innen zugute kommen, die eine Rückenmarksverletzung erlitten haben, sagt Zampieri: „Wenn wir die Details der Propriozeption besser verstehen, kann man das Design von Neuroprothesen optimieren, die die eingeschränkten motorischen oder sensorischen Fähigkeiten der verletzten Menschen übernehmen.“
Krummer Rücken wegen veränderter Muskelspannung
Darüber hinaus hätten Forschende in Israel kürzlich herausgefunden, dass eine gut funktionierende Propriozeption auch wesentlich für ein gesundes Knochenskelett sei, sagt Zampieri. Manche Jugendliche entwickeln zum Beispiel während des Wachstums eine Skoliose, bei der die Wirbelsäule verkrümmt und zugleich verdreht ist. „Dies liegt vermutlich daran, dass aufgrund einer gestörten Propriozeption die Muskelspannung im Rücken verändert ist und die Wirbelsäule sich dadurch verformt“, erläutert Zampieri.
Auch eine Hüftdysplasie, eine Fehlstellung des Hüftgelenks, sei womöglich die Folge einer mangelhaften Propriozeption. Der Forscher hat somit noch ein weiteres Ziel vor Augen: „Wenn wir den sechsten Sinn besser durchschauen, lassen sich neue Therapien entwickeln, die solchen und anderen skelettalen Schäden effektiv entgegenwirken.“
Text: Anke Brodmerkel
Weiterführende Informationen
Literatur
Stephan Dietrich et al. (2022): „Molecular identity of proprioceptor subtypes innervating different muscle groups in mice“, Nature Communications, DOI: 10.1038/s41467-022-34589-8
Bild zum Download
Zellpopulationen von sensorischen Neuronen in einem Spinalganglion des Rückenmarks (rechts) und ihre Axone im Rückenmark (links): Die Zellen, die grün dargestellt sind, erfassen propriozeptive Informationen; die rot angefärbten Zellen in Rot Wärme und Berührung. Foto: Stephan Dietrich, AG Zampieri, Max Delbrück Center
Kontakte
Dr. Niccolò Zampieri
Leiter der Arbeitsgruppe „Entwicklung und Funktion von neuronalen Netzwerke“
Max Delbrück Center
+49 30 9406 3321 (Büro)
Niccolo.Zampieri@mdc-berlin.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max Delbrück Center
+49 30 9406-2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Max Delbrück Center
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.