Ein genetischer Aufpasser für ein gesundes Altern?
Forscherinnen und Forscher des Berliner Instituts für Medizinische Systembiologie (BIMSB) des MDC haben ein Protein entdeckt, das erheblichen Einfluss auf eine gesunde Muskulatur und die Lebenserwartung hat. Wenn Tiere dieses Protein namens LIN-53 fehlt, haben sie schwerwiegende Muskelschäden und eine eingeschränkte Beweglichkeit. Sie sterben früher im Vergleich zu Tieren, die dieses Protein haben.
Dr. Baris Tursun, der Leiter des Labors „Genregulation und Zelltypspezifizierung in C. elegans“ am BIMSB, und seine Kolleginnen und Kollegen haben zwei spezifische Signalwege entdeckt, über die LIN-53 in Rundwürmern (C. elegans) funktioniert. Ihre Ergebnisse, die in der Zeitschrift Aging Cell veröffentlicht wurden, legen den Grundstein für weitere Studien an der menschlichen Version des Proteins.
„Wir wollen genetische Faktoren identifizieren, die Lebens- und Gesundheitsspanne verknüpfen. Das ist ein Schlüssel zum Verständnis der menschlichen Gesundheit und von altersbedingten Erkrankungen wie beispielsweise Muskeldystrophie“, sagt Tursun.
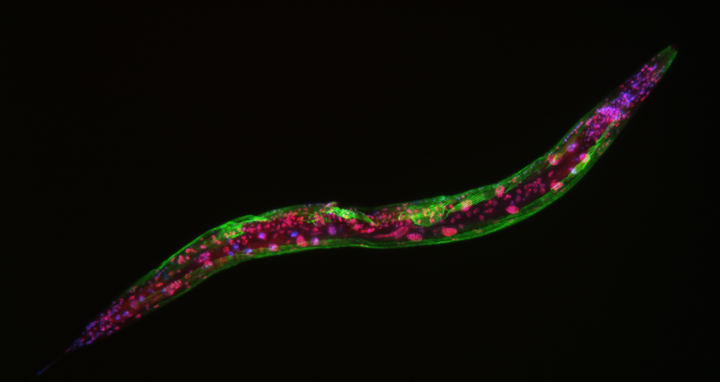
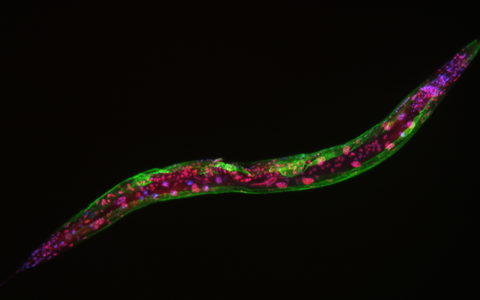
C. elegans, markiert mit Fluoreszenzmarkern. Die grüne Farbe hebt das Muskelgewebe hervor, während die roten Farben LIN-53-Proteine anzeigen. Die Rundwürmer verfügen nicht über LIN-53-Protein in ihrem Muskelgewebe, was zu Muskelschäden führt. Die Zellkerne sind blau/violett eingefärbt.
Epigenetischer Faktor
LIN-53 ist nicht irgendein Protein, es ist ein „Histon-Chaperon“. Es bindet an Histone, also jene Moleküle, an die sich die langen DNA-Stränge eng anschmiegen, um in den Zellkern zu passen. Verändert sich ein Histon kann das letztendlich dazu führen, dass das Ablesen der Gene hoch- oder heruntergefahren wird. Das wiederum beeinflusst die Entwicklung, Funktion und Lebenserwartung eines Organismus. LIN-53 gilt als „epigenetischer Faktor“, weil das Protein durch sein Zusammenspiel mit Histonen dabei hilft, Gene zu aktivieren oder zu deaktivieren. So können vererbbare Eigenschaften auf den Nachwuchs übergehen, ohne dass dabei die zugrundeliegende DNA-Sequenz verändert wird.
Tursun und sein Team wollten verstehen, ob dieser epigenetische Faktor Einfluss darauf hat, wie lange ein Organismus lebt (Lebensspanne) und wie lange der Organismus dabei gesund ist (Gesundheitsspanne). Sie wollten außerdem herausfinden, ob Lebens- und Gesundheitsspanne unmittelbar zusammenhängen.
„Wenn wir älter werden, bemerken wir normalerweise Alterungserscheinungen, die von einem Verlust von Muskelmasse begleitet sind“, sagt Tursun. „Handelt es sich dabei um Zufälle oder gibt es da einen Zusammenhang? Falls es einen Zusammenhang gibt, wie sind diese Faktoren genau miteinander verknüpft? Unsere Studie ist eine der ersten Veröffentlichungen, die eine epigenetische Verbindung zeigt."
Ein Faktor, zwei Wege
Das Team untersuchte die Rolle von LIN-53 in Caenorhabditis elegans (C. elegans), einem nur einen Millimeter langen Wurm. C. elegans wird auch als Nematode bezeichnet und ist einer der primären Modellorganismen in der Alterungsforschung, da viele seiner Gene hochgradig konserviert sind oder artenübergreifend gefunden werden.
„Es ist ein so kleiner Organismus und trotzdem sind menschliche Gewebe, Signalwege und Genregulation ähnlich. Deshalb können wir die Ergebnisse vom Nematoden auf den Menschen übertragen“, sagt Stefanie Müthel, Erstautorin der Veröffentlichung und Postdoktorandin im Labor für Myologie des Experimental and Clinical Research Center (ECRC), einer gemeinsamen Einrichtung von Charité und MDC.
Als die Wissenschaftlerinnen und Wissenschaftler das Gen für LIN-53 entfernten, bewegten sich die Würmer weniger und lebten nicht so lange wie die Vertreter, die dieses Gen noch hatten.
Das zeigt, dass LIN-53 eine wichtige Rolle für eine gesunde Muskulatur und die Lebensspanne spielt. Das Team forschte weiter und entdeckte, dass LIN-53 die Entwicklung der Muskulatur durch den molekularen Komplex NuRD und die Lebensspanne durch einen anderen Komplex, Sin3, beeinflusst. Die Tatsache, dass LIN-53 an zwei unterschiedlichen Signalwegen beteiligt ist, ist besonders faszinierend und deutet nachdrücklich auf die Bedeutung von LIN-53 als Bindeglied zwischen Lebens- und Gesundheitsspanne hin.
„LIN-53 ist ein Teil von sieben unterschiedlichen molekularen Komplexen, die die Modifizierung und Struktur des Chromatins regulieren“, sagt Müthel. „Ich war überrascht und glücklich darüber, dass wir die Komplexe klar definieren konnten, die für die Gesundheits- und Lebensspanne von Bedeutung sind."
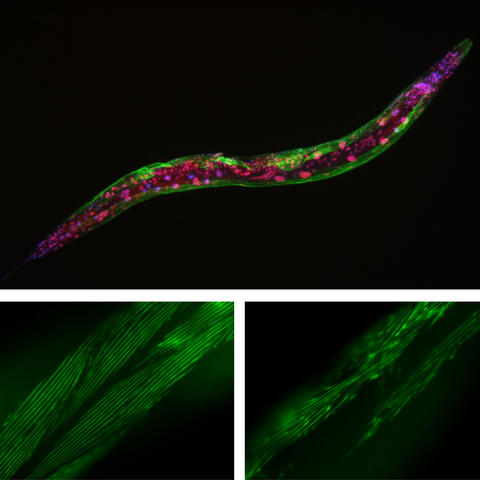
C. elegans ohne LIN-53-Protein (rechts) weist im Vergleich zum Rundwurm mit LIN-53-Protein (links) eine ungewöhnliche Struktur der Muskelfasern auf. Sie starben außerdem im Durchschnitt fünf Tage früher. Das weist darauf hin, dass LIN-53 sowohl die Gesundheits- als auch die Lebensspanne beeinflusst.
Der gute Zucker
Weitere Analysen lieferten eine mögliche Erklärung dafür, warum LIN-53 so leistungsfähig ist. Tiere ohne LIN-53 hatten nur geringe Werte eines Zuckers, der als Trehalose bezeichnet wird. Er besteht aus zwei Glukosemolekülen und ist für eine normale Lebensspanne bei Wirbellosen unerlässlich. Die Interaktion zwischen LIN-53 und Sin3 betraf Gene, die den Stoffwechsel regulieren, einschließlich der Produktion dieses Zuckers. Um zu verstehen, wie genau LIN-53 mit NuRD und Sin3 interagiert und die Zuckerbildung hemmt, sind weitere Studien erforderlich.
Da das Protein LIN-53 und das menschliche Protein RBBP4/7 nahezu identisch sind, können Wissenschaftlerinnen und Wissenschaftler die Erkenntnisse, die sie mithilfe des mikroskopisch kleinen Wurms erlangt haben, als Wegweiser nutzen, um beim Menschen nach Antworten zu ähnlichen Fragen zu finden.
„Wir möchten alle gesund altern“, sagt Tursun. „Sobald wir die Zusammenhänge zwischen dem Altern und allen begleitenden nachteiligen Auswirkungen kennen, können wir überlegen, wie wir sie voneinander abkoppeln können.“
Laura Petersen
Weiterführende Informationen
Literatur
Stefanie Müthel et al. (2019): “The conserved histone chaperone LIN-53 is required for normal lifespan and maintenance of muscle integrity in Caenorhabditis elegans” Aging Cell, https://doi.org/10.1111/acel.13012
Kontakte
Dr. Baris Tursun
Leiter des Labors „Genregulation und Zelltypspezifizierung in C. elegans“ am Berliner Institut für Medizinische Systembiologie (BIMSB)
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-1730
Baris.Tursun@mdc-berlin.de
Jana Schlütter
Redakteurin, Kommunikationsabteilung
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-2121
jana.schluetter@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.