Neuer Schwung für schwache Herzen
Patient*innen mit Herzinsuffizienz sind oft kurzatmig und schnell erschöpft. Sie leiden häufig unter Wassereinlagerungen, Herzrasen und Schwindel. Auslöser der Erkrankung können die Kombination von erhöhtem Blutdruck, Diabetes und Nierenerkrankungen sein oder akute Ereignisse wie Infarkte oder Infektionen. Mit zunehmendem Lebensalter summieren sich die Auslöser, sodass vor allem ältere Menschen von Herzschwäche betroffen sind, insbesondere Frauen.
Auch wenn die Symptome sich gleichen, sind die Ursachen unterschiedlich. Bei einer Form der Erkrankung ist die Pumpfunktion des Organs beeinträchtigt. Sie lässt sich aber medikamentös verbessern. Bei der anderen hingegen pumpt das Herz zwar ausreichend stark – doch die Herzkammern füllen sich nicht mehr richtig, weil die Ventrikelwände versteift oder verdickt sind. Für diese Form der Herzschwäche gibt es noch immer keine effektive Therapie. Ein Team um Professor Michael Gotthardt vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) hat nun zusammen mit Forschenden der Universität Heidelberg und einem Team des in Kalifornien ansässigen Unternehmens Ionis Pharmaceuticals einen Wirkstoff entwickelt, um Herzinsuffizienz mit erhaltener Pumpfunktion medikamentös zu behandeln. Im Fachjournal „Science Translational Medicine“ beschreiben die Wissenschaftlerinnen und Wissenschaftler ihren neuen Therapieansatz.
Riesenprotein Titin beeinflusst die Elastizität des Herzens
Die mechanischen Eigenschaften der Titine sind nur schwer zu beeinflussen. Aber wir können jetzt in den Prozess eingreifen, der der Proteinsynthese vorausgeht – das alternative Spleißen.
Die Mechanik des Herzens wird von einem elastischen Riesenprotein namens Titin beeinflusst. Es wird von der Herzmuskelzelle in unterschiedlichen Varianten (Isoformen) produziert, die sich in ihrer Flexibilität unterscheiden. Während bei Neugeborenen sehr elastische Titin-Proteine überwiegen, werden später, wenn Wachstums- und Umbauprozesse abgeschlossen sind, zur Steigerung der Pumpleistung steifere Titin-Isoformen gebildet. Bei Herzschwäche mit erhaltener Pumpfunktion können verdickte Herzwände, Einlagerung von Bindegewebe und steifere Titin-Filamente die Füllung der Herzkammern beeinträchtigen.
Herzmuskelzellen können sich bei Erwachsenen praktisch nicht mehr erneuern. Das Titin wird jedoch durch die permanente Pumpaktivität des Herzmuskels so stark beansprucht, dass die verschlissenen Proteine alle drei bis vier Tage abgebaut und ersetzt werden müssen. „Die mechanischen Eigenschaften der Titine sind nur schwer zu beeinflussen. Aber wir können jetzt in den Prozess eingreifen, der der Proteinsynthese vorausgeht – das alternative Spleißen“, sagt Michael Gotthardt. Alternatives Spleißen ist ein raffinierter Trick der Natur, um auf Basis eines einzelnen Gens eine Vielfalt ähnlicher Proteine zu bilden – so auch die verschiedenen Formen des Titins. Kontrolliert wird dieser Prozess durch Spleißfaktoren. „Einer davon, der Masterregulator RBM20, ist ein geeignetes Ziel, das wir therapeutisch angehen können“, erklärt Michael Gotthardt.
Antisense-Wirkstoff schaltet RBM20 ab
RBM20 bestimmt die elastischen, kontraktilen und elektrischen Eigenschaften der Herzkammern. Dass es tatsächlich der entscheidende Faktor ist, zeigten Vorversuche mit genetisch veränderten Mäusen, die nur halb so viel RBM20 bilden können wie ihre Artgenossen: Bei ihnen bilden sich vermehrt elastischere Titin-Isoformen. Gemeinsam mit dem Team von Ionis Pharmaceuticals suchten die Forschenden nun nach einem Weg, RBM20 zu beeinflussen. „Wir waren überrascht, wie einfach dies möglich ist“, sagt Gotthardt – nämlich mit Antisense-Oligonukleotiden (ASOs). Das sind kurzkettige, einzelsträngige Nukleinsäuren, die synthetisch hergestellt werden. Sie binden spezifisch an der komplementären Sequenz der RNA, dem Bauplan des angepeilten Proteins, und blockieren so dessen Synthese.
Dr. Michael Radke, einer der Erstautoren der Studie, testete die ASOs zunächst erfolgreich bei Mäusen mit steiferen Herzwänden. Anschließend züchtete sein Kollege Victor Badillo Lisakowski aus menschlichen Stammzellen Herzmuskelzellen und ließ daraus künstliches Herzgewebe wachsen. Die winzigen 3D-Strukturen können angeregt werden, gegen einen Widerstand zu kontrahieren und sich zu entspannen. So lässt sich an ihnen die Pumpsituation des Herzens nachbilden. Auch an diesem künstlichen Herzgewebe zeigte sich der Effekt der Behandlung: Die Forschenden konnten nachweisen, dass die ASO-Moleküle tatsächlich in die Zellen eindringen und die gewünschte Reaktion auslösen. „Diese Tests am künstlichen Herzgewebe waren ein wichtiger Schritt, denn die Primärsequenzen für das Titin sind bei Maus und Mensch nicht identisch“, sagt Michael Radke.
Eine wöchentliche Spritze?
Diese Tests am künstlichen Herzgewebe waren ein wichtiger Schritt, denn die Primärsequenzen für das Titin sind bei Maus und Mensch nicht identisch.
Es ist erstmals gelungen, mit Antisense-Oligonukleotiden das alternative Spleißen bei Herzkrankheiten therapeutisch zu beeinflussen. Bei Ionis ist es gelungen, das empfindliche Molekül so stabilisieren, dass es im Mausmodell die quergestreifte Muskulatur erreicht und nicht schon in Blut, Leber oder Niere abgebaut wird. Der Großteil kommt im Herzen an, etwas gelangt auch in den Skelettmuskel. „Im Mausmodell haben wir jedoch gesehen, dass es keinen störenden Effekt hat, wenn auch im Skelettmuskel vermehrt elastische Titine gebildet werden“, betont Michael Radke.
Herzinsuffizienz ist eine chronische Erkrankung, die eine langfristige Behandlung erfordert. „Wir haben unsere Mäuse deshalb auch über einen längeren Zeitraum therapiert und sehen anhaltende Behandlungseffekte“, sagt Michael Gotthardt. An der Therapieform sei noch zu arbeiten. „Schöner als eine wöchentliche Spritze, die viele Patientinnen und Patienten bereits von Insulin oder Heparin kennen, wäre eine orale Form.“
Text: Catarina Pietschmann
Weiterführende Informationen
- Wie Titin das Herzwachstum beeinflusst
- Pressemitteilung: Titin in Echtzeit verfolgen
- Pressemitteilung: Phantastische Muskelproteine und wo sie zu finden sind
Literatur
Michael H. Radke et al. (2021): „Therapeutic inhibition of RBM20 improves diastolic function in a murine heart failure model und human engineered heart tissue“. Science Translational Medicine, DOI: 10.1126/scitranslmed.abe8952
Bilder zum Download
Bitte nur im Zusammenhang mit der Berichterstattung zur Publikation verwenden!
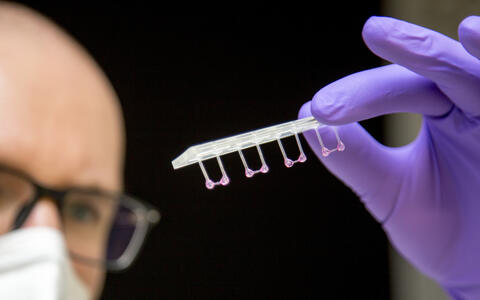
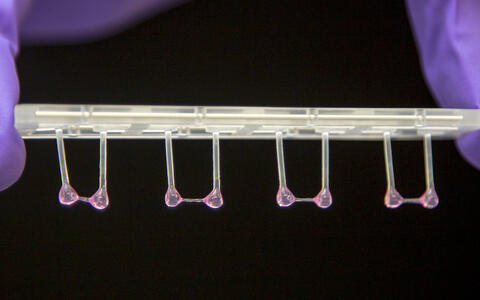
- Künstliches Herzgewebe unter mechanischer Belastung in einem Plastikeinsatz. Foto: M. Gotthardt, MDC
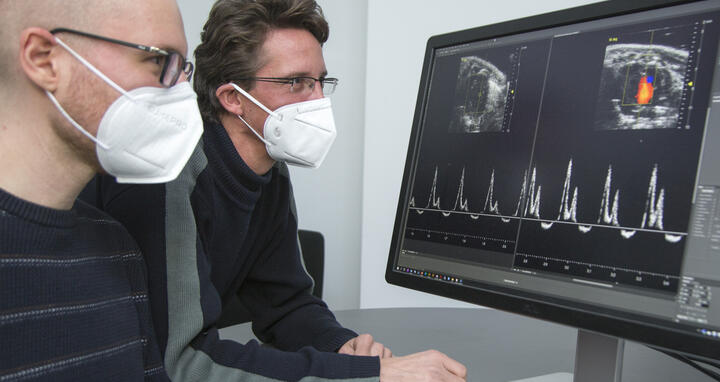
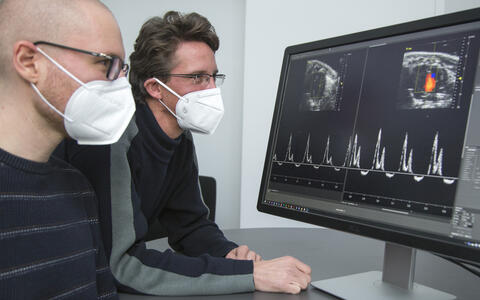
- Victor Badillo Lisakowski (li.) und Dr. Michael Radke (re.) aus der AG „Neuromuskuläre und kardiovaskuläre Zellbiologie“ von Professor Michael Gotthardt. Auf dem Bildschirm: Originaldaten aus der Ultraschalluntersuchung des Mausherzen mit und ohne Behandlung. Foto: M. Gotthardt, MDC
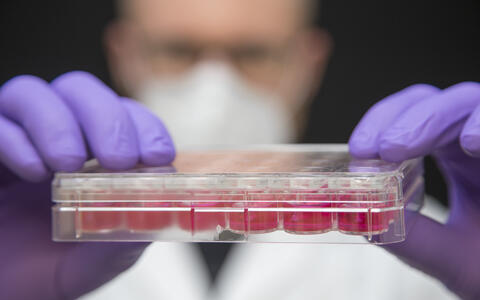
- Victor Badillo Lisakowski züchtete aus menschlichen Stammzellen Herzmuskelzellen und ließ daraus künstliches Herzgewebe wachsen. Foto: M. Gotthardt, MDC
- Das künstliche Herzgewebe kann angeregt werden, gegen einen Widerstand zu kontrahieren und sich zu entspannen. Foto: M. Gotthardt, MDC
Kontakte
Prof. Michael Gotthardt
AG Neuromuskuläre und kardiovaskuläre Zellbiologie
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-2245
gotthardt@mdc-berlin.de
Jana Ehrhardt-Joswig
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-2118
jana.ehrhardt-joswig@mdc-berlin.de oder presse@mdc-berlin.de
- Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.