Titin in Echtzeit verfolgen
Während festliche Beleuchtung allerorten die Weihnachtszeit erhellt, freuen sich Forscher*innen am Max-Delbrück-Centrum für Molekulare Medizin (MDC) aus einem ganz anderen Grund über rote und grüne Lichter: Mithilfe fluoreszierender Markierungen hat ein Team den gesamten Lebenszyklus von Titin verfolgt. Das ist das größte Protein im Körper, das für seine Schlüsselrolle in Muskelgewebe bekannt ist. Titin von seiner Entstehung bis zum Zerfall zu beobachten, habe neuartige Einsichten in die Bildung von Sarkomeren ermöglicht, den kleinsten kontraktilen Einheiten von Herz- und Skelettmuskulatur. Das berichten sie in der Fachzeitschrift Proceedings of the National Academy of Sciences.
Wir können jetzt beobachten, wie Titin entsteht und ins Myofilament des Muskels eingefügt wird, während alles andere weiterarbeitet. Das ist ein wunderbarer Anblick
Titin ist ein derart großes Molekül, dass seine Analyse das Team vor einzigartige Herausforderungen gestellt hat. Die Wissenschaftler*innen brachten an entgegengesetzten Enden des Proteins rote und grüne Markierungen an. Das ermöglichte ihnen, die genauen Bewegungen des Titin in aus Mäuseherzen gewonnenen Muskelzellen – den Kardiomyozyten – zu beobachten.
„Kardiomyozyten sind hochspezialisiert und dürfen keinen einzigen Herzschlag lang aussetzen“, sagt Michael Gotthardt, Leiter der Arbeitsgruppe „Neuromuskuläre und kardiovaskuläre Zellbiologie“ am MDC und führender Kopf der Studie. „Wir können jetzt beobachten, wie Titin entsteht und ins Myofilament des Muskels eingefügt wird, während alles andere weiterarbeitet. Das ist ein wunderbarer Anblick.“
Mehr als ein schönes Bild
Titin in Echtzeit beobachten zu können, ermöglicht neue Erkenntnisse. Seit langem wurde Titin für das starre Rückgrat der Sarkomere gehalten, der kleinsten funktionalen Einheiten von Herz- und Skelettmuskulatur, die sich ausdehnen und zusammenziehen. Es habe sich nun herausgestellt, dass Titin weitaus dynamischer sei als zuvor angenommen, sagt Gotthardt.
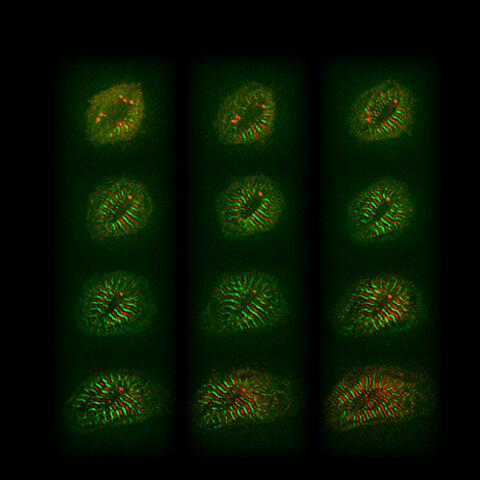
Umbauprozesse in Herzmuskelzellen, die zur Ausbildung und Reifung von Sarkomeren führen (rote und grüne Streifen; 12 Stunden).
Herzmuskelzellen verfügen anscheinend über einen Vorrat löslichen Titins, der sich durch das Sarkomer verteilt und bereit ist, durch den repetitiven Prozess von Muskelausdehnung und -kontraktion beschädigte Proteine zu ersetzen. Überbeanspruchte Proteine werde aus den Zellen heraustransportiert und abgebaut. Dies alles geschieht innerhalb weniger Stunden, was nach einem schnellen Verlauf klingt, tatsächlich aber sehr viel längere Zeit in Anspruch nimmt als bei jedem anderen Sarkomer-Protein.
Die große Menge Titin außerhalb der Sarkomere war eine Überraschung. Es konnte dank des neuen genetischen Mausmodells und des neuen bildgebenden Verfahrens zum ersten Mal beobachtet werden, berichtet Gotthardt. Ein weiterer unerwarteter Fund war die beobachtete Diversität der Titin-Moleküle, sogenannter Isoformen. Proteine, die sich schneller bewegen, sind wahrscheinlich andere Isoformen als solche, die sich langsamer bewegen.
„Das ist ein Blick auf das wahre Leben der Sarkomere“, sagt Gotthardt. „Wir können so die Bildung und Umgestaltung der Myofilamentstruktur verstehen. Das ist relevant für Erkrankungen und die Entwicklung des Menschen.“
Potenzielle Anwendungen
Mithilfe der fluoreszierenden Markierungen können Wissenschaftler*innen erforschen, wie sich Muskeln nach dem Sport erneuern oder wie sich Herzmuskulatur nach einem Infarkt repariert. Vielleicht kann man mit ihnen auch Herzerkrankungen besser verstehen, die mit Mutationen in anderen Sarkomer-Proteinen in Zusammenhang zu tun haben, sagt Franziska Rudolph, die Erstautorin der Studie.
Muskelzellen in der Weihnachtszeit (Collage aus Einzelzellen, die Titin-GFP und titin-DsRed exprimieren).
„Es ist erstaunlich, endogene Titin-Varianten von Anfang bis Ende in Echtzeit verfolgen zu können“, sagt Rudolph. „Mit diesen Mausmodellen und den unterschiedlichen bildgebenden Verfahren sind viele Experimente möglich.“
Die Technik könnte beispielsweise dafür genutzt werden, implantierte Zellen zu verfolgen – um zu beobachten, wie gut sie sich in das ursprüngliche Muskelgewebe integrieren, ob sie sich einwandfrei mit ihren neuen Nachbarn verbinden, um als Einheit zu arbeiten, oder ob sie das nicht tun. Derartige Erkenntnisse könnten zeigen, ob Zell-Therapien wirksam sind.
Die neuartigen Werkzeuge zu überprüfen und Methoden zur Bildauswertung festzulegen, waren eine Herausforderung, die die Zusammenarbeit mit Kolleg*innen des Berliner Institut für Medizinische Systembiologie des MDC, der Universitätsmedizin Göttingen und der University of Arizona erforderte. Das Team hat hart daran gearbeitet, zu zeigen, dass die gentechnisch erzeugten fluoreszierenden Proteine keine unerwarteten Nebenwirkungen auf die Entwicklung und Funktion von Muskeln oder Titin hatten.
Mit den neuen Werkzeugen werden die Wissenschaftler*innen weiterhin an Titin forschen. Unter anderem widmen sie sich der Frage, wie Skelettmuskeln auf Sport reagieren.
Laura Petersen
Weiterführende Informationen
Pressemitteilung: „Wie Titin das Herzwachstum beeinflusst“
Literatur
Franziska Rudolph et al. (2019): Resolving titin’s lifecycle and the spatial organization of protein turnover in mouse cardiomyocytes, PNAS, DOI: 10.1073/pnas.1904385116.
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.