Wie Rochen gelernt haben, durchs Wasser zu gleiten
Der Knorpel des Rochens ist blau (Alcianblau) zu sehen, die Knochen rot (Alzarinrot). Das Marine Resources Center des Marine Biology Laboratory in Woods Hole ist einer der wenigen Orte auf der Welt, die Leucoraja erinacea sammeln und für die Forschung züchten – auch für diese Studie.
Der Kleine Rochen tanzt anmutig auf dem Meeresboden: Seine Brustflossen umgeben ihn wie ein weiter Mantel. Sie bewegen sich wellenartig, während er unter einer Sandschicht entlang gleitet. Mit seiner gesprenkelten sandfarbenen Tarnung ist der Fisch leicht zu übersehen.
Forscher*innen des Max Delbrück Center, des Andalusischen Zentrums für Entwicklungsbiologie (CABD) in Sevilla und andere Arbeitsgruppen haben nun herausgefunden, wie sich diese umhangähnlichen Flossen der Rochen entwickeln konnten. Der Schlüssel zur Flossen-Evolution liegt demnach nicht in den kodierenden Teilen des Genoms, sondern in den nicht-kodierenden Regionen und den dreidimensionalen Komplexen, in die sie gefaltet sind. Diese 3D-Strukturen werden TADs genannt: „topologisch assoziierte Domänen“.
Wenn Mutationen im Genom die TADs verändern, kann das die Evolution in neue Richtungen lenken, schreibt das internationale Team jetzt in „Nature“. Bis vor wenigen Jahren lag der Fokus von Evolutionsbiolog*innen auf den Veränderungen der DNA-Sequenz und nicht auf der Ebene der dreidimensionalen Struktur des Genoms. „Das ist eine neue Perspektive darauf, wie sich das Erbgut im Laufe der Evolution weiterentwickelt“, sagt Dr. Darío Lupiáñez, Genetiker am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft in Berlin und einer der Letztautoren der Studie.
„Wir wussten zwar schon seit einiger Zeit, dass einzigartige Genexpressionsmuster für die außergewöhnlich breiten Flossen der Rochen verantwortlich sind. Aber bisher war unbekannt, wie sich die Regulation des Genoms dafür verändern musste“, sagt Co-Autor Dr. Tetsuya Nakamura, Entwicklungsbiologe an der Rutgers University.
Weit entfernte Verwandtschaft
Vor mehr als 450 Millionen Jahren hat sich das Genom eines primitiven Ur-Fisches zweimal verdoppelt. Diese Vervielfältigung des genetischen Materials hat die rasante Evolution von mehr als 60.000 Wirbeltierarten ermöglicht, auch die des Menschen. Zu unseren entferntesten Verwandten unter den Wirbeltieren zählt der Kleine Igelrochen (Leucoraja erinacea). Die Tiere gehören zu den Knorpelfischen, so wie alle Rochen und Haie. Für die Wissenschaft sind sie ideale Organismen, um die Evolution von Merkmalen zu analysieren, die uns zum Menschen machen – wie gepaarte Gliedmaßen.
„Rochen gehören zu den Knorpelfischen, also den Chondrichthyens. Sie ähneln den Vorfahren der heutigen Wirbeltiere am ehesten“, sagt Dr. Christina Paliou, Entwicklungsbiologin am CABD und eine der Erstautor*innen. „Wir können die Charakteristika der Rochen mit anderen Arten vergleichen und so feststellen, was neuartig ist und was von früheren Vorfahren stammt.“
Eine spannende Zeit für die Evolutionsgenomik
Der inzwischen verstorbene CABD-Forscher Dr. José Luis Gómez-Skarmeta, eine prägende Persönlichkeit in der Evolutionsgenomik, hat im Jahr 2017 Wissenschaftler*innen aus allen Ecken der Welt um sich geschart, um die Evolution der Rochen zu analysieren: Arbeitsgruppen mit Expertise zur Evolution des Genoms wie die AG von Ferdinand Marlétaz am University College London und Daniel Rokhsar an der University of California-Berkeley; mit Expertise zur Biologie der Rochen wie die AG von Neil Shubin an der University of Chicago, wo Tetsuya Nakamura damals forschte; und mit Expertise zur 3D Genregulation wie die AGs von Juan Tena am CABD, von Darío Lupiáñez und von Gómez-Skarmeta sowie weitere Labore. Gómez-Skarmeta wollte wissen, wie strukturelle und funktionelle Änderungen im Genom das Entstehen neuer Merkmale fördern. „Wie sich die Genregulation im Verlauf der Entwicklung immer wieder ändert, hat wesentlichen Anteil an der Evolution“, sagte er 2018.
Wie die DNA gepackt ist, ist alles andere als zufällig.
Es war eine spannende Zeit in der Evolutionsgenomik. Die Technologien zur Genomsequenzierung hatten sich erheblich verbessert; Wissenschaftler*innen konnten nun ermitteln, wie der meterlange DNA-Faden in einen Zellkern mit nur fünf Mikrometern Durchmesser verstaut ist. „Wie die DNA gepackt ist, ist alles andere als zufällig“, sagt Lupiáñez. Die DNA ist in dreidimensionale Strukturen gefaltet: die TADs. Sie beinhalten sowohl Gene als auch Sequenzen, die sie regulieren. Dank der 3D-Struktur werden die richtigen Gene zur richtigen Zeit in den richtigen Zellen an- und abgeschaltet.
Welche TADs unterscheiden sich bei Rochen und Haien?
Dr. Rafael Acemel, Genetiker am Max Delbrück Center und einer der Erstautor*innen, nutzte für seine Experimente die Hi-C-Technologie, um die 3D-Strukturen der TADs zu analysieren. Doch die Interpretation der Ergebnisse war eine Herausforderung – die Wissenschaftler*innen brauchten zunächst ein komplettes Rochen-Genom als Referenz. „Zu dem Zeitpunkt konnten wir nur auf Tausende kleine und ungeordnete Stückchen von DNA-Sequenzen zurückgreifen. Das hat nicht geholfen“, sagt Acemel.
Um die DNA-Teile wie ein Puzzle zusammensetzen zu können und die ungeordneten Sequenzen den Rochen-Chromosomen zuzuordnen, haben die Wissenschaftler*innen die HI-C-Daten mit Long-Read-Sequencing kombiniert. Mit der neuen Referenz war es schließlich ein Kinderspiel, die 3D-Struktur der TADs anhand der HI-C-Daten zu rekonstruieren.
Das Team verglich das genauere Rochen-Genom mit den Genomen der engsten Verwandten wie Haien. So konnten die Forscher*innen TADs identifizieren, die sich im Laufe der Evolution verändert hatten. In diesen veränderten TADs befinden sich Gene des Wnt/PCP-Signalweges, der für die Entwicklung der Flossen wichtig ist. Auch eine Variation in den nicht-kodierenden Sequenzen nahe der Hox-Gene gab es ausschließlich bei den Rochen. Sie reguliert ebenfalls die Entwicklung der Flossen. „Diese spezifische Sequenz kann mehrere Hox-Gene im vorderen Teil der Flossen aktivieren. Und das passiert nicht bei anderen Fischen oder bei vierbeinigen Tieren“, sagt Paliou. Funktionale Experimente bestätigten schließlich, dass die molekularen Veränderungen den Rochen zu ihren einzigartigen Flossen verholfen haben.
TADs treiben die Evolution voran
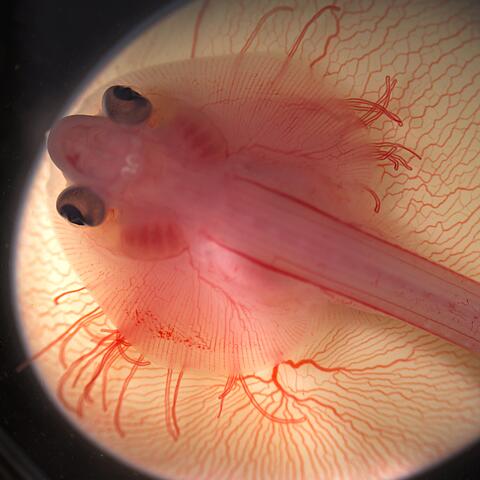
Der Embryo des Kleinen Igelrochen (etwa 10 Wochen alt) sitzt auf dem Eigelb.
Frühere Studien hatten bereits belegt, dass TADs das An- und Abschalten von Genen beeinflussen und so Krankheiten beim Menschen verursachen können. In der aktuellen Studie zeigen die Forscher*innen die Rolle der TADs in der Evolution – ähnlich wie sie es zuvor bei Maulwürfen getan hatten.
Nachdem der primitive Fisch-Vorfahr sein Genom verdoppelt hatte, gingen viele ungenutzte und überflüssige Teile verloren. „Da verschwanden nicht nur Gene, sondern auch die regulatorischen Elemente und die TADs, in denen beide enthalten waren“, sagt Lupiáñez. „Ich halte das für ein wirklich spannendes Ergebnis. Denn es legt nahe, dass die 3D-Struktur des Genoms die Evolution beeinflusst.“
TADs sind zentral für die Genregulation, und etwa 40 Prozent sind in allen Wirbeltieren konserviert – sie blieben also gleich, sagt Acemel. „Aber 60 Prozent der TADs haben sich im Laufe der Evolution auf die eine oder andere Art und Weise verändert. Was hat das für Folgen für die Entstehung der Arten? Ich glaube, wir kratzen derzeit erst an der Oberfläche dieses spannenden Phänomens“, sagt Acemel.
Mechanismen der Evolution, die an die TADs gebunden sind, könnten in der Natur weitverbreitet sein. „Wir vermuten, dass diese Mechanismen noch viele andere interessante Erscheinungsformen des Lebens (Phänotypen), die wir aus der Natur kennen, erklären können“, sagt Lupiáñez. „Wenn wir diese neuen Ebenen der Genexpression, der Genregulation und der 3D-Struktur des Chromatins berücksichtigen, könnte sich für das Feld der Evolutionsgenomik eine neue Ära der Entdeckungen eröffnen.“
Text: gav
Weiterführende Informationen
- Einflussreiche Barrieren
- Maulwürfe: Intersexuell und genetisch gedopt
- CABD – Gene Regulation and Morphogenesis (nur EN)
- Hunting Down the Enhancers of Evolution: How Does a Fin Become a Limb? (nur EN)
Literatur
Ferdinand Marlétaz, Elisa de la Calle-Mustienes, Rafael D. Acemel, Christina Paliou et al. (2023): „The little skate genome and the evolutionary emergence of wing-like fin appendages“. Nature, DOI: 10.1038/s41586-023-05868-1
Bilder zum Download
- Der Knorpel des Rochens ist blau (Alcianblau) zu sehen, die Knochen rot (Alzarinrot). Das Marine Resources Center des Marine Biology Laboratory in Woods Hole ist einer der wenigen Orte auf der Welt, die Leucoraja erinacea sammeln und für die Forschung züchten – auch für diese Studie. Foto: David Gold Lynn Kee und Meghan Morrissey, MBL-Embryologie-Kurs
- Rochen-Embryo (Leucoraja erinacea): Die blaue Färbung (Alcianblau) zeigt den Knorpel. Foto: Elena Boer, MBL-Embryologie-Kurs
- Der Embryo des Kleinen Igelrochen (etwa 10 Wochen alt) sitzt auf dem Eigelb. Foto: Mary Colasanto und Emily Mis, MBL-Embryologie-Kurs
- Dr. Darío Lupiáñez im Labor. Foto: David Ausserhofer, Max Delbrück Center
Kontakte
Dr. Darío Lupiáñez
Leiter der Arbeitsgruppe „Epigenetik und geschlechtliche Entwicklung”
Max Delbrück Center
+49 (0) 30 9406 1425 (Büro) Dario.Lupianez@mdc-berlin.de
Jana Schlütter
Redakteurin, Kommunikation
Max Delbrück Center
+49 (0) 30 9406 2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Max Delbrück Center
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.