Ein Schalter für die Gene
Das bakterielle Operon fasziniert evolutionäre Entwicklungsbiolog*innen (EvoDevo), seit die Franzosen Francois Jacob, Jaques Lucien Monod und André Lwoff anhand eines simplen Modells erklärten, wie es funktioniert. Das von ihnen beschriebene lac-Operon gilt es als einer der wichtigsten Ausgangspunkte für das Erforschen der Genregulation. 1965 erhielten sie dafür den Nobelpreis für Physiologie und Medizin.
Dr. Darío G. Lupiáñez, Haupt-Organisator des EMBO-Workshops
Wie das bakterielle Operon die EvoDevo-Forschung vorangebracht hat und noch heute beeinflusst, schildert Michael Levine, Professor für Molekularbiologie und Direktor des Lewis-Sigler-Instituts für Integrative Genomik an der Universität von Princeton, in seiner Keynote beim virtuellen Workshop „The evolution of animal genomes“ der European Molecular Biology Organization (EMBO). Der Workshop findet vom 13. bis 17. September 2021 statt. Internationale Expert*innen tauschen sich dort darüber aus, wie die Vielfalt des Lebens zustande gekommen ist und wie moderne Technologien und Methoden – etwa die Long-Range-Genomsequenzierung oder Methoden zur Erfassung der Chromosomenkonformation, mit denen regulatorische Wechselwirkungen im gesamten Genom ermittelt werden können – dazu beitragen, die Evolution zu entschlüsseln.
Dr. Darío G. Lupiáñez, der am Berliner Institut für Medizinische Systembiologie (BIMSB) des Max-Delbrück-Centrums für Molekulare Biologie in der Helmholtz-Gemeinschaft (MDC) die Arbeitsgruppe „Epigenetics and Sex Development“ leitet, ist Haupt-Organisator des Workshops, den die EMBO mit 32.600 Euro finanziert.
- In Gedenken an José Luis Gómez-Skarmeta
-
-
„Wir veranstalten diesen EMBO Workshop in Gedenken an unseren Mitorganisator José Luis Gómez-Skarmeta, einen angesehenen EvoDevo-Forscher und engen Freund“, sagt Darío Lupiáñez. José Luis Gómez-Skarmeta, der während der Workshop-Vorbereitungen verstorben ist, leistete Pionierarbeit bei der Erforschung der Frage, wie das nicht-kodierende Genom komplexe Genexpressionsmuster steuert und wie Veränderungen in solchen Sequenzen zu evolutionären Anpassungen führen können. Mit seiner Arbeit hat er wesentlich zum Verständnis der Genregulation beigetragen.
Der eleganteste Nobelpreis aller Zeiten
Professor Levine, was hat es mit dem bakteriellen Operon auf sich?
Michael Levine: Das Operon ist ein Schalter, der Gene an- und ausknipst. Die französischen Wissenschaftler Francois Jacob, Jaques Lucien Monod und André Lwoff haben dafür in den 50er und frühen 60er Jahren ein bestechend einfaches Modell entwickelt. Es basiert auf Escherichia coli-Mutanten mit gestörtem Laktosestoffwechsel und wird deshalb Laktose-Operon, kurz lac-Operon genannt. Wird zu einer Bakterienkultur Laktose hinzufügt, werden die Enzyme aktiviert, die die Laktose in die Zelle transportieren und dort verstoffwechseln, um daraus Energie zu gewinnen. 1965 gab es dafür den Nobelpreis für Physiologie oder Medizin – einer der elegantesten Nobelpreise, die je verliehen wurden!
Inwiefern elegant?
Der lac-Operon-Mechanismus ist einfach von Natur aus schön.
Der lac-Operon-Mechanismus ist einfach von Natur aus schön. Dass die Gene die Enzymsynthese und damit die Grundvoraussetzung für das Ablesen der genetischen Informationen kontrollieren, war damals eine große Überraschung. Man ist vorher davon ausgegangen, dass die Enzyme von vornherein in der Bakterienzelle vorhanden sind. Dass sie sozusagen darauf warten, Laktose verstoffwechseln zu können. Aber nein, in dem Moment, in dem Laktose auftaucht, muss in der DNA erst ein Schalter umgelegt werden, damit die Enzyme gebildet werden, die für diesen Stoffwechsel erforderlich sind. Genau das geschieht auch bei der Transkription: Die Zelle empfängt ein Signal, etwa ein Hormon oder einen Reiz, die Gene werden angeknipst – oder auch nicht. In Bakterien und den meisten Einzellern passiert das direkt am Promotor. Der Promotor ist ein kurzer Abschnitt des Operons, der als Startplatz für die RNA-Polymerase dient. Die RNA-Polymerase ist ein Enzym, das für die Transkription – das Ablesen der genetischen Informationen – benötigt wird. In der Nähe des Promoters befindet sich der Operator. Der Operator bindet an Proteine, die den Promoter aktivieren oder blockieren können. Sie werden deshalb auch Aktivatoren und Repressoren genannt. Bindet der Operator an einen Repressor, ist der Weg für die Polymerase blockiert. Es gibt keine Transkription, keine Genexpression, keine Genaktivität. Aktivatoren hingegen schalten die Repressoren aus. Dann bindet die Polymerase an den Promoter, transkribiert und aktiviert das Gen, so dass die entsprechenden Proteine hergestellt werden. 99 Prozent der gesamten Genregulation in der Natur funktioniert nach diesem einfachen und doch so eleganten Prinzip.
In höher entwickelten Tieren hingegen werden die Gene von Enhancern reguliert. Diese Enhancer, auch Transkriptionsverstärker genannt, sind sehr weit von den Genen entfernt. Sie scheinen nicht in unmittelbarer Verbindung miteinander zu stehen, sondern kommunizieren oft über mehrere Tausend DNA-Basenpaare hinweg.
Das Operon wirkt im Verborgenen weiter
Das bakterielle Operon ist also im Lauf der Evolution verschwunden?
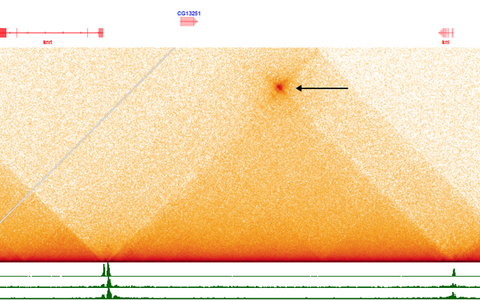
Bei oberflächlicher Betrachtung sieht es tatsächlich so aus, als wäre dieser wunderbare Mechanismus verloren gegangen. Doch zwei Postdoktoranden in meiner Arbeitsgruppe, Joao Raimundo und Xiao Li, haben mit der Hilfe der Long-Range-Sequenzierung entdeckt, dass die Enhancer aufgrund der Faltung der DNA physisch mit Promotoren verbunden sind. Auch zwischen den Promotoren von Genen, die bis zu 250.000 Nukleotide voneinander entfernt sind, gibt es Berührungspunkte. So kann ein Enhancer mehrere Gene gleichzeitig regulieren, indem er ihre Promotoren ein- oder ausschaltet – genau wie das bakterielle Operon. Wir nennen diesen Schalter „topologisches Operon“ oder „Toperon“. Das bakterielle Operon ist also in höheren Organismen nicht verschwunden – es arbeitet nur im Verborgenen. Wir glauben, dass etwa zehn Prozent der Gene auf diese Weise reguliert werden. Mithilfe von Genomanalysen können wir nun herausfinden, welche das sind.
Mithilfe der Long-Range-Sequenzierung aufgespürt: das "topologische Operon".
Transkription ist alles
Warum interessiert Sie das?
Viele Forscher*innen suchen nach einer Erklärung für die vielfältigen Erscheinungsformen des Lebens. Ich denke, dass die Antwort in den Mechanismen der Genregulation liegt: Transkription ist alles. Deshalb möchte ich sie entschlüsseln.
Welche Fragen gilt es dafür zu lösen?
Die große Herausforderung für die Evolutions- und Entwicklungsbiologie besteht darin, die Faltung und Dynamik der Genaktivität zu verstehen. Dafür müssen wir das Genom – nicht nur in seiner räumlichen Struktur, sondern auch im Zeitverlauf – genau analysieren.
Mit Omics-Technologien die Evolution entschlüsseln
Welche Rolle spielen dabei Technologien wie die Genomseqenzierung oder die Einzelzellanalyse?
Wir werden verstehen, (...) warum Elefanten einen Rüssel und Menschen fünf Finger haben.
Dank dieser Technologien erleben wir gerade eine unglaublich aufregende Zeit. Einzelzelltechnologien ermöglichen es unter anderem, die gesamte exprimierte RNA wie auch alle aktiven und inaktiven Gene in einer Zelle zu identifizieren. Sie ermöglichen uns, verschiedene Zelltypen miteinander zu vergleichen. Sie werden uns helfen zu verstehen, wie sie sich im Laufe der Evolution entwickelt haben. Ich kann mir sogar vorstellen, dass wir in der Lage sein werden, das Urtier mit seinen 20 oder 30 verschiedenen Zelltypen zu rekonstruieren. Und wir werden verstehen, wie sich jeder dieser Zelltypen zu Hunderten von Zelltypen beim Menschen entwickelt hat. Warum Elefanten einen Rüssel und Menschen fünf Finger haben. Wenn wir dank dieser Technologien die Genregulation verstanden haben, dann wissen wir auch, wie sich die unterschiedlichen Organismen entwickelt haben.
Das Interview führte Jana Ehrhardt-Joswig.