Neue Immuntherapie gegen Krebs in der klinischen Prüfung
Nach 20 Jahren Vorarbeit in den Laboren des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und der Charité – Universitätsmedizin Berlin, aus der unter anderem die Biotech-Ausgründung T-knife entstanden ist, kommt nun die Idee von einer neuen Gentherapie gegen Krebs erstmals in der Klinik zum Einsatz. Vor einigen Wochen hat die erste Patientin mit Multiplem Myelom eine Infusion mit ihren T-Zellen bekommen. Die körpereigenen Immunzellen waren zuvor gentechnisch so verändert worden, dass ihre Rezeptoren den Krebs erkennen und bekämpfen können. Das Multiple Myelom ist eine der häufigsten Tumorerkrankungen der Knochen und des Knochenmarks.
Primär geht es jetzt darum nachzuweisen, wie sicher diese neue Form der Immun- und Gentherapie für die Patientinnen und Patienten ist.
Zwölf Patient*innen sollen in der auf zwei Jahre angelegten Phase-I-Studie behandelt werden. „Primär geht es jetzt darum nachzuweisen, wie sicher diese neue Form der Immun- und Gentherapie für die Patientinnen und Patienten ist“, sagt Professor Antonio Pezzutto, der die Studie an der Medizinischen Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie am Campus Benjamin Franklin der Charité leitet. „Zwar glauben wir, Hinweise auf die Wirksamkeit des Therapieprinzips zu bekommen und hoffen auch, dass die Patientinnen und Patienten davon profitieren. Aber erst in der nächsten klinischen Phase kann gezielt die Wirksamkeit der Therapie an einer größeren Zahl von Betroffenen untersucht werden.“ Das Bundesministerium für Bildung und Forschung (BMBF) fördert das Kooperationsprojekt mit vier Millionen Euro.
- Klinische Studien
-
-
Neue Arzneimittel werden in einem standardisierten Verfahren auf Sicherheit und Wirksamkeit getestet, bevor sie für die regelhafte Anwendung zugelassen werden. In einer Phase-I-Studie wird ein Therapeutikum – nach umfangreicher Vorprüfung – erstmals beim Menschen angewendet, um vorläufige Daten über die Verträglichkeit und Sicherheit sowie weitere Auswirkungen auf den Organismus zu erhalten. Die Anzahl der Studienteilnehmer ist klein. Treten keine bedenklichen Nebenwirkungen auf und gibt es erste Hinweise auf eine mögliche Wirksamkeit, schließt sich eine Phase-II-Studie an. Dabei werden Verträglichkeit und Nebenwirkungen bei einer etwas größeren Anzahl von Patienten ermittelt und die Dosierung in Hinblick auf eine mögliche Wirksamkeit optimiert. Erst in Phase-III-Studien, die sich oft über Jahre hinziehen und eine große Anzahl von Teilnehmern einschließen, kann der Nachweis der Wirksamkeit der neuen Substanz erbracht werden. Hierzu wird die neue Substanz mit anderen verfügbaren und bereits zugelassenen Medikamenten verglichen. Erst Phase-III-Studien liefern die Daten, die für die behördliche Zulassung notwendig sind.
T-Zell-Training
T-Zellen überwachen unseren Körper und schützen ihn vor Krankheiten, beispielsweise durch Infektionen mit Viren. Infizierte Zellen verraten sich durch virale Antigene, die als typische Merkmale auf ihrer Oberfläche auftreten. Spürt eine T-Zelle ein Antigen mit Hilfe ihres Rezeptors auf, zerstört sie die befallene Zelle oder mobilisiert weitere Kräfte gegen sie. Auch bei Krebszellen sitzen spezielle Antigene auf der Oberfläche. Das Problem: Das Immunsystem erkennt diese oft nicht als entartet und bekämpft die Zelle nicht.
Das könnte sich mit der T-Zell-Gentherapie nun ändern, die Professor Thomas Blankenstein, Leiter der Arbeitsgruppe „Molekulare Immunologie und Gentherapie“ am MDC und ehemaliger Direktor des Instituts für Immunologie an der Charité, gemeinsam mit seinem Team entwickelt hat. Die Forschenden wollen den T-Zellen der Studienteilnehmenden nun beibringen, Krebszellen als Eindringlinge zu identifizieren. „Unsere präklinischen Versuche deuten darauf hin, dass dies geschehen sollte, ohne dabei gesundes Gewebe der Patientinnen und Patienten zu schädigen“, sagt Blankenstein.
Einzigartige Technologie-Plattform
Wir schauen mit Spannung auf die Studienergebnisse und hoffen, dass wir mit dieser Gentherapie eine neue und vielversprechende Möglichkeit gewinnen, Krebserkrankungen künftig besser zu bekämpfen.
Als ersten Kandidaten für die Behandlung des Multiplen Myeloms nahm das Forschungsteam das Antigen MAGE-A1 ins Fadenkreuz – ein typisches Erkennungsmerkmal auf der Oberfläche von Krebszellen, das bei Multiplen Myelomen häufiger auftritt. Die Wissenschaftler*innen haben dafür einen spezifischen T-Zell-Rezeptor hergestellt. Er schafft es, das Antigen und somit die Krebszelle als entartet und gefährlich einzustufen.
Möglich war dies mit einer einzigartigen Technologieplattform, die Blankensteins Team für die Gentherapie entwickelt hat: eine transgene Maus mit ausschließlich humanem T-Zell-Repertoire. „Wird die transgene Maus mit einem menschlichen Antigen immunisiert, vermehren sich nur T-Zellen mit passgenauen Rezeptoren und können leicht isoliert werden“, sagt Blankenstein. „Auf diese Weise konnten wir den genetischen Bauplan von Rezeptoren menschlichen Ursprungs gewinnen, wie sie aus Menschen in der Regel nicht zu gewinnen sind. Die T-Zell-Rezeptoren werden dann zunächst einer Serie von Sicherheits- und Wirksamkeitstests unterzogen. Das ist für eine sichere Behandlung von Patientinnen und Patienten mit Knochenmarkkrebs wichtig.“
So läuft die Behandlung ab
Die Herstellung der Zellprodukte für die gesamte Studie erfolgt in der GMP-Facility für zelluläre Therapien am Experimental and Clinical Research Center (ECRC), einer Einrichtung, die auf die Produktion von Zell- und Gentherapeutika in Reinräumen spezialisiert ist. Das ECRC ist ein gemeinsames Institut von MDC und Charité. Zunächst entnahmen Ärzt*innen der ersten Patientin T-Zellen, die dann den Spezialist*innen vom ECRC übergeben wurden. Diese brachten die Erbinformationen des spezifischen Rezeptors in die körpereigenen T-Zellen ein, aktivierten und vermehrten sie. Wenige Tage vor der Behandlung erhielt die Patientin eine Chemotherapie, um andere Immunzellen im Körper zu eliminieren. Der Angriff auf die Krebszellen ist dann besonders effektiv. Nach der Behandlung mit ihren gentechnisch veränderten T-Zellen wurde die Patientin für zwei Wochen stationär an der Charité überwacht und muss sich seither und auch in Zukunft regelmäßig für Untersuchungen vorstellen. Behandelnder Arzt ist unter anderem Matthias Obenaus, der diesen T-Zell-Rezeptor im Rahmen seiner Doktorarbeit isoliert und charakterisiert hat.
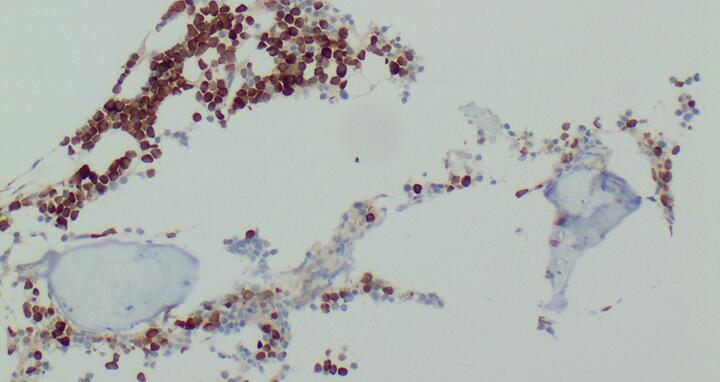
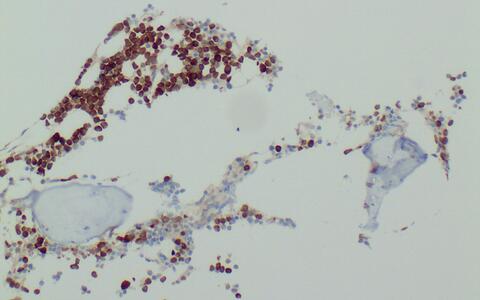
Bei einem Multiplen Myelom enthält das Knochenmark viele entartete Plasmazellen, die das Antigen MAGE-1A (braun) produzieren. Die gentechnisch mit einem MAGE-1A-spezifischen Rezeptor ausgestatteten T-Zellen erkennen das Antigen und bekämpfen die Tumorzellen gezielt.
Neben MAGE-A1 hat das Team weitere vielversprechende Antigene entdeckt, die bei anderen Krebserkrankungen auftreten. T-knife wird nun passende Rezeptoren herstellen und testen. So sollen zukünftig immer mehr Patient*innen von der Gentherapie von MDC und Charité profitieren können.
„Wir schauen mit Spannung auf die Studienergebnisse und hoffen, dass wir mit dieser Gentherapie eine neue und vielversprechende Möglichkeit gewinnen, Krebserkrankungen künftig besser zu bekämpfen“, sagt Blankenstein.
Text: Nicole Silbermann
Gemeinsame Pressemitteilung von Charité und MDC
Weitere Informationen
Download
Bei einem Multiplen Myelom enthält das Knochenmark viele entartete Plasmazellen, die das Antigen MAGE-1A (braun) produzieren. Die gentechnisch mit einem MAGE-1A-spezifischen Rezeptor ausgestatteten T-Zellen erkennen das Antigen und bekämpfen die Tumorzellen gezielt. © von Brünneck / Charité
Kontakte
Professor Thomas Blankenstein
Leiter der AG Molekulare Immunologie und Gentherapie
Max-Delbrück-Center für Molekulare Medizin in der Helmholtz Gemeinschaft (MDC)
tblanke@mdc-berlin.de
Matthias Obenaus
Medizinische Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie
Campus Benjamin Franklin
Charité – Universitätsmedizin Berlin
Tel.: 49 30 450 513 382
matthias.obenaus@charite.de
Jana Ehrhardt-Joswig
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Tel.: +49-(0)30-9406-2118
jana.ehrhardt-joswig@mdc-berlin.de oder presse@mdc-berlin.de
- Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.