Warum COVID-19-Kranke lange beatmet werden müssen
Gemeinsame Pressemitteilung der Charité, des HIRI, des MDC und der Uniklinik RWTH Aachen
Bei der Mehrheit der Patientinnen und Patienten mit schwerem COVID-19 vernarbt die Lunge in außergewöhnlich starkem Ausmaß. Das zeigen Forschende der Charité – Universitätsmedizin Berlin, des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI), des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), der Uniklinik RWTH Aachen und des Robert Koch-Instituts in einer aktuellen Studie. Wie sie in der Fachzeitschrift „Cell“ beschreiben, spielen Fresszellen des Immunsystems eine zentrale Rolle. Einige Prozesse des COVID-19-Lungenversagens ähneln dabei denen der idiopathischen Lungenfibrose, einer bisher unheilbaren Form der Lungenvernarbung. Die gestörte Narbenreaktion könnte erklären, warum die Lunge lange funktionsunfähig bleibt und eine langwierige ECMO-Therapie erfordert.
Die Lunge ist besonders schwer geschädigt
Patientinnen und Patienten mit schwerem COVID-19 haben oft ein sehr stark ausgeprägtes Lungenversagen.
Bei Patientinnen und Patienten mit schwerem COVID-19-Verlauf versagt die Lunge ihren Dienst: Sie ist so schwer geschädigt, dass der Körper nicht mehr genügend Sauerstoff aus der Luft aufnehmen kann. Fachleute sprechen von einem Acute Respiratory Distress Syndrome, kurz ARDS. Nur mit der Gabe von Sauerstoff, einer unterstützenden Beatmung oder sogar dem Einsatz einer künstlichen Lunge – der ECMO – haben Betroffene eine Chance, ein solches akutes Lungenversagen zu überleben. Im Vergleich zu anderen Ursachen für ein Lungenversagen ist die Lungenschädigung bei COVID-19 besonders schwer. „Patientinnen und Patienten mit schwerem COVID-19 haben oft ein sehr stark ausgeprägtes Lungenversagen“, sagt Professor Leif Erik Sander von der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité, einer der beiden korrespondierenden Leiter der Studie. „Die weitgehende Zerstörung ihrer Lungenstruktur erfordert eine invasive Beatmung oder sogar eine ECMO-Behandlung über längere Zeit und geht leider mit einer sehr hohen Sterblichkeit von etwa 50 Prozent einher.“
Als Grund für die lange Dauer des Lungenversagens hatte das Forschungsteam unter anderem eine spezielle Form des ARDS im Verdacht, bei der das Lungengewebe vernarbt, dadurch verdickt und unelastisch wird. Schon relativ früh in der Pandemie war bei einzelnen Patient*innen ein solcher als Fibrose bezeichneter Umbau des Gewebes aufgefallen. Die aktuelle Studie des interdisziplinären Forschungskonsortiums aus ganz Deutschland bestätigt nun, dass das schwere COVID-19-bedingte Lungenversagen tatsächlich sehr häufig von einer ausgeprägten Vernarbung des Lungengewebes begleitet wird. „Eine fehlgeleitete Reaktion der Makrophagen, die auch als Fresszellen des Immunsystems bekannt sind, könnte dafür mitverantwortlich sein“, konstatiert Dr. Antoine-Emmanuel Saliba, Arbeitsgruppenleiter am HIRI in Würzburg und zweiter korrespondierender Leiter der Studie.
Proben aus Lungenspülungen und -gewebe
Für die Studie untersuchte das Team die Lungen verstorbener COVID-19-Patienten anhand verschiedener mikroskopischer Aufnahmen. „Bei fast allen Betroffenen haben wir enorme Schäden entdeckt: Die Lungenbläschen waren weitgehend zerstört, die Wände deutlich verdickt. Außerdem fanden wir ausgeprägte Ablagerungen von Kollagen, welches ein Hauptbestandteil von Narbengewebe ist. All dies ist charakteristisch für eine schwere Fibrose“, beschreibt Professor Peter Boor die Befunde. Er hat die Studie am Institut für Pathologie der Uniklinik RWTH Aachen geleitet. „Diese Beobachtungen weisen darauf hin, dass wir es beim COVID-19-Lungenversagen mit einem fibroproliferativen ARDS zu tun haben, also einer besonders schweren Form des Lungenversagens. Das könnte erklären, warum wir die Betroffenen so lange beatmen müssen.“
Der Grund für dieses Phänomen war zunächst unklar. „Bei COVID-19 entwickelt sich ein Lungenversagen typischerweise erst in der zweiten oder dritten Woche nach Symptombeginn, wenn die Viruslast eigentlich schon wieder sinkt“, erklärt Sander. „Das weist darauf hin, dass nicht die unkontrollierte Virusvermehrung zum Versagen der Lunge führt, sondern nachgeschaltete Reaktionen, beispielsweise des Immunsystems, eine Rolle spielen.“ Die Wissenschaftlerinnen und Wissenschaftler analysierten deshalb die Zusammensetzung und Eigenschaften der Immunzellen in Lungenspülungen und -gewebe schwer erkrankter beziehungsweise verstorbener COVID-19-Patient*innen. Dazu nutzten sie modernste Methoden der Einzelzellanalyse. Mit ihnen ist es möglich, jede einzelne Zelle im Detail zu betrachten.
SARS-CoV-2 programmiert die Immunzellen um
SARS-CoV-2 ist also zumindest ein möglicher Auslöser für die fehlgeleitete Reaktion der Fresszellen.
Das Team konnte so zeigen, dass sich in der Lunge von COVID-19-Betroffenen, die ein Lungenversagen entwickeln, vor allem Makrophagen in großen Mengen ansammeln. Diese Fresszellen beseitigen zum Beispiel eingedrungene Erreger oder Zellabfall, sind aber auch an der Wundheilung und Reparatur von Gewebe beteiligt. „Überraschenderweise zeigten die Makrophagen bei schwerem COVID-19 ähnliche Eigenschaften wie bei einer chronischen Form der Lungenvernarbung, der idiopathischen Fibrose“, betont Saliba. Bei dieser unheilbaren Erkrankung vernarbt die Lunge unaufhaltsam bis zum Verlust der Organfunktion. Die Ursache ist unbekannt, unter allen Formen der Lungenfibrose hat sie die schlechteste Prognose. „Die Makrophagen treten bei schwerem COVID-19 mit bestimmten Zellen des Bindegewebes in Kontakt, die für die Bildung von Narbengewebe verantwortlich sind. Diese Zellen vermehren sich stark und produzieren große Mengen Kollagen“, ergänzt der Experte der Einzelzellforschung.
In der Zellkultur entdeckten die Wissenschaftlerinnen und Wissenschaftler, dass SARS-CoV-2 selbst die Fresszellen so beeinflusst, dass sie den Fibroseprozess möglicherweise befeuern. Dazu isolierten sie Fresszell-Vorläufer aus dem Blut gesunder Menschen und stimulierten sie mit dem Virus. Wie eine Analyse von etwa 7000 Proteinen zeigte, produzierten die Immunzellen daraufhin verstärkt Botenstoffe, die Vernarbungsprozesse einleiten, ganz ähnlich wie bei einer idiopathischen Lungenfibrose. „SARS-CoV-2 ist also zumindest ein möglicher Auslöser für die fehlgeleitete Reaktion der Fresszellen“, erklärt Professor Matthias Selbach. Der Proteomik-Experte hat die Studie am MDC geleitet. „Das Virus vermehrt sich dabei anscheinend nicht in den Immunzellen, sondern programmiert sie um. Diesen Effekt konnten wir interessanterweise nicht beobachten, wenn wir die Makrophagen mit einem Grippevirus stimulierten. Das Influenza-Virus vermehrte sich in den Immunzellen stark. Es brachte sie aber nicht dazu, Vernarbungsprozesse zu fördern.“
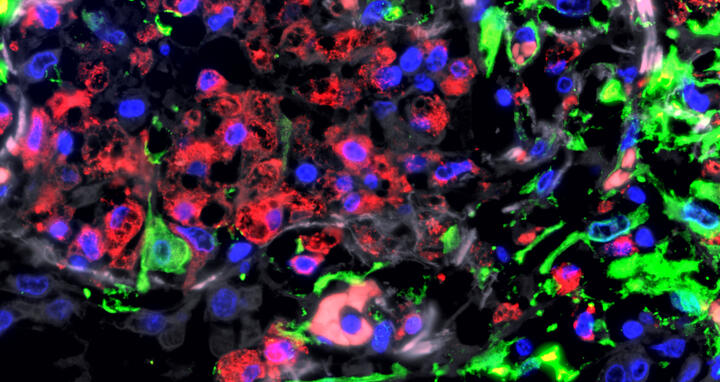
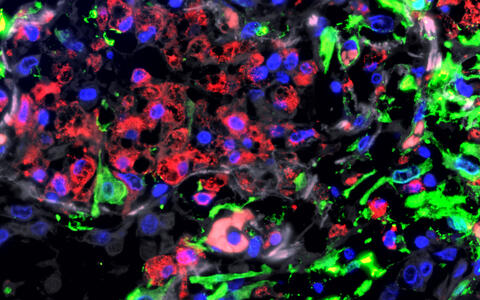
Immunfluoreszenz-Aufnahme der Lunge eines Patienten mit schwerem COVID-19: In dem stark geschädigten Lungengewebe sammeln sich Fresszellen (Makrophagen, rot) an. Grün angefärbt sind Bindegewebszellen (Fibroblasten).
Warum kann sich die Fibrose zurückbilden?
„Unsere Daten zeigen also eindeutig Parallelen zwischen COVID-19 und der chronischen Lungenfibrose auf“, resümiert Saliba. „Das erklärt vielleicht, warum einige Risikofaktoren für COVID-19 auch Risikofaktoren für die idiopathische Lungenfibrose sind – zum Beispiel Grunderkrankungen, Rauchen, ein männliches Geschlecht und ein Alter über 60 Jahre. Es gibt jedoch einen entscheidenden Unterschied zwischen den beiden Erkrankungen: Bei COVID-19 ist die Vernarbung zumindest potenziell reparabel.“ Das konnte das Forschungsteam anhand von CT-Bildern nachvollziehen. Bei COVID-19-Erkrankten, die mit der ECMO behandelt wurden, zeigten die Aufnahmen zunächst typische milchglasartige Trübungen, die sich im Verlauf der Erkrankung verdichteten und vernarbten. Bei Betroffenen, die von der ECMO-Behandlung entwöhnt werden konnten und genasen, gelang es dem Körper, die Verdichtungen allmählich aufzulösen – auch wenn in manchen Fällen deutliche Vernarbungsreste zurückblieben.
Die Wissenschaftlerinnen und Wissenschaftler wollen nun genauer untersuchen, welche zellulären Prozesse dazu führen, dass sich eine Fibrose zurückbildet. „Wenn wir die Auflösung von vernarbtem Gewebe besser verstehen, können wir in Zukunft hoffentlich nicht nur COVID-19-Betroffenen, sondern auch Patientinnen und Patienten mit bisher unheilbarer Lungenfibrose helfen“, sagt Sander. „Die wichtige Rolle der Makrophagen für beide Krankheiten legt außerdem nahe, dass eine Hemmung der Zellen dazu beitragen könnte, die Vernarbung zu verhindern.“ An der Charité untersuchen Forschungsgruppen beispielsweise die Wirksamkeit einer Blockade von Rezeptoren, die den Fresszellen den Eintritt in das Lungengewebe ermöglichen.
Zur Studie
Die Studie erfolgte im Rahmen eines bundesweiten Konsortiums, der „Deutschen COVID-19 OMICS Initiative“ (DeCOI). Gefördert wurde die Arbeit hauptsächlich durch die Deutsche Forschungsgemeinschaft (DFG) sowie im Rahmen des Berliner Proteomik-Forschungskerns MSTARS und verschiedener Verbundprojekte des Netzwerks Universitätsmedizin (NUM) durch das Bundesministerium für Bildung und Forschung (BMBF) und unterstützt durch das Deutsche Register für COVID-19 Obduktionen (DeRegCOVID).
Das NUM wurde auf Initiative der Charité gegründet und wird von ihr koordiniert. Es vereint die Kräfte der 36 Universitätsklinika in Deutschland. Basis für die Generierung der jetzt veröffentlichten Daten war die Studienplattform Pa-COVID-19, die zentrale longitudinale Registerstudie für COVID-19-Patientinnen und -Patienten an der Charité. Sie zielt darauf ab, COVID-19-Betroffene klinisch sowie molekular schnell und umfassend zu untersuchen, um individuelle Risikofaktoren für schwere Verlaufsformen sowie prognostische Biomarker und Therapieansätze zu identifizieren. Das Protokoll zur Studie ist hier veröffentlicht.
Text: Charité
Weiterführende Informationen
- Pressemitteilung zu DeCOI: „Coronavirus-Forschung mit vereinten Kräften“
- Pressemitteilung zum Berliner Proteomik-Kern MSTARS: „Massenspektronomie für die Präzisionsmedizin“
- Coronaforschung am MDC
-
Einzelzellanalyse am MDC
- Medizinische Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité
- Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI)
- Uniklinik RWTH Aachen
- Robert Koch-Institut
Literatur
Daniel Wendisch, Oliver Dietrich, Tommaso Mari, Saskia von Stillfried et al. (2021): „SARS-CoV-2 infection triggers profibrotic macrophage responses and lung fibrosis“. Cell, DOI: 10.1016/j.cell.2021.11.033
Fotos zum Download
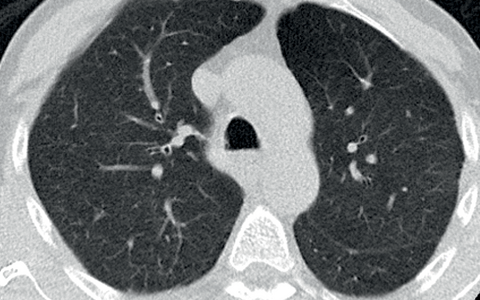
Computertomographie-Aufnahme (CT-Bild) der Lunge eines Patienten mit COVID-19-Lungenversagen. Helle Bereiche zeigen Verdichtungen und Vernarbungen des Lungengewebes.
© Charité | Mirja Mittermaier
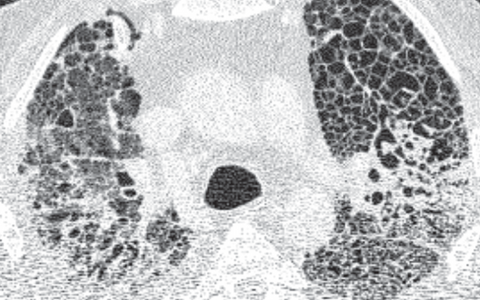
Computertomographie-Aufnahme (CT-Bild) der Lunge eines gesunden Menschen.
© Charité | Mirja Mittermaier
Immunfluoreszenz-Aufnahme der Lunge eines Patienten mit schwerem COVID-19: In dem stark geschädigten Lungengewebe sammeln sich Fresszellen (Makrophagen, rot) an. Grün angefärbt sind Bindegewebszellen (Fibroblasten).
© Uniklinik RWTH Aachen | Saskia von Stillfried
Kontakte
Prof. Dr. Leif Erik Sander
Medizinische Klinik mit Schwerpunkt Infektiologie und Pneumologie
Charité – Universitätsmedizin Berlin
über Markus Heggen
Pressesprecher der Charité
+49 30 450 570 400
presse@charite.de
Dr. Antoine-Emmanuel Saliba
Helmholtz-Institut für RNA-basierte Infektionsforschung
Helmholtz-Zentrum für Infektionsforschung
Würzburg
+49 931 3181 801
presse@helmholtz-hiri.de
Prof. Dr. Matthias Selbach
Leiter der Arbeitsgruppe „Proteom-Dynamik“
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406 3574
matthias.selbach@mdc-berlin.de
Jana Schlütter
Redakteurin, Abteilung Kommunikation
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49 30 9406-2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin. www.mdc-berlin.de