Wie Bakterien in der Magenschleimhaut das Gewebe verändern
Gemeinsame Pressemitteilung von Charité und MDC
Die komplexen Interaktionen verschiedener Zellen und Signale, die für die Stabilität des Gewebes sorgen, werden durch eine Infektion gestört.
Eine Besiedelung des Magens mit Helicobacter pylori tritt weltweit bei etwa der Hälfte der Menschheit auf; sie zählt damit zu den häufigsten chronischen bakteriellen Infektionen. In der Folge können sich Entzündungen des Magens (Gastritis) oder Magenkrebs entwickeln. Wegen des ständigen Kontakts mit der Magensäure erneuert sich die gesunde Magenschleimhaut innerhalb weniger Wochen komplett, wobei ihre Struktur und Zusammensetzung stets unverändert bleibt. „Bisher ging man davon aus, dass eine Helicobacter-Infektion die Drüsenzellen der Magenschleimhaut direkt schädigt“, erklärt Professor Michael Sigal, Letztautor der Studie. „Unser Team hat nun herausgefunden, dass die komplexen Interaktionen verschiedener Zellen und Signale, die für die Stabilität des Gewebes sorgen, durch eine Infektion gestört werden.“
Michael Sigal ist Emmy Noether-Arbeitsgruppenleiter an der Medizinischen Klinik mit Schwerpunkt Hepatologie und Gastroenterologie der Charité und am Berliner Institut für Medizinische Systembiologie (BIMSB), das zum MDC gehört. Um die Veränderungen der Magendrüsen durch eine Helicobacter-Infektion nachzuverfolgen, hat sich das Team um Michael Sigal zusammen mit Forschenden vom Max-Planck-Institut für Infektionsbiologie komplexe Mausmodelle zu Nutze gemacht, bei denen sich bestimmte Zellen der Magendrüsen mittels modernster Technologien – wie Bildgebung und Einzelzellsequenzierung am Gewebe – visualisieren, isolieren und genau untersuchen lassen. Darüber hinaus entwickelten sie im Labor spezielle organähnliche Mikrostrukturen – sogenannte Organoide –, um damit den Einsatz von Tiermodellen einschränken zu können. Mithilfe dieser winzigen Miniaturmägen konnten sie viele Eigenschaften der Drüsen nachempfinden und den Einfluss verschiedener Signale auf die dortigen Stammzellen, aus denen verschiedene Zelltypen entstehen können, untersuchen.
Stromazellen unterdrücken BMP-Signalweg
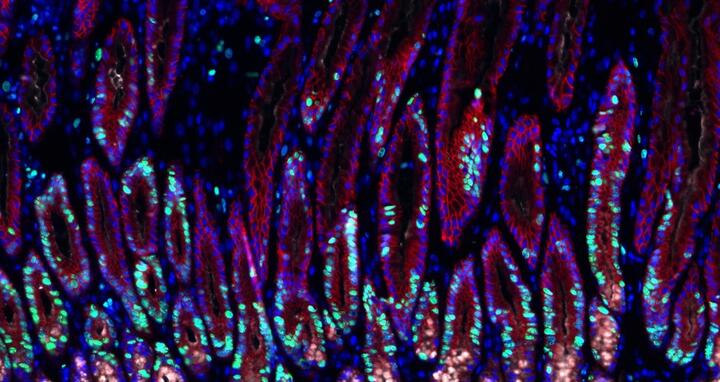
Mit Helicobacter-Bakterien infiziertes Magengewebe. Sich teilende Zellen sind grün, Zellkerne blau dargestellt.
„Wir haben herausgefunden, dass die sogenannten Stromazellen, welche die Drüsen umgeben, nicht – wie bisher gedacht – nur für die mechanische Stabilität verantwortlich sind. Sie produzieren auch verschiedene Botenstoffe, die das Verhalten der Drüsen maßgeblich beeinflussen“, beschreibt Michael Sigal. Zu diesen Botenstoffen gehört auch das „Bone Morphogenetic Protein“ (BMP), das für die Gewebeentwicklung von Bedeutung ist. Die Forschenden konnten zeigen, dass Stromazellen, die die Drüsenbasis umgeben, den BMP-Signalweg fortwährend unterdrücken und so die Teilung der dortigen Stammzellen anregen. Hingegen aktivieren Stromazellen an der Drüsenspitze den Signalweg und unterbinden dort die Zellteilung. Dieser Einfluss der Umgebung ist die Grundlage für die stabile Drüsenstruktur. Durch eine Helicobacter-Infektion kommt es hingegen zur Ausschüttung von Endzündungsstoffen wie Interferon-gamma (IFN-γ). Im Zuge dieser Entzündungsreaktion werden nun vermehrt Botenstoffe produziert, die die Zellteilung der Stammzellen in den Drüsen anregen. Das führt schließlich zur sogenannten Hyperplasie – also dazu, dass sich das Gewebe vergrößert und Krebsvorläufer entstehen können.
„Unsere Erkenntnisse zeigen, dass eine Infektion und damit einhergehende Entzündung viel mehr Effekte im Gewebe hat als bisher angenommen: Klassische Entzündungsstoffe wie IFN-γ haben nicht nur eine direkte antimikrobielle Wirkung, sondern beeinflussen auch die Zellteilung und das Verhalten von Stammzellen im Gewebe. Bei einer Gewebeschädigung kann eine schnelle Zellteilung sehr sinnvoll sein, um eine rasche Heilung zu ermöglichen. Bei einer chronischen Entzündung im Zuge einer Helicobacter-Infektion könnte sie jedoch die Entwicklung von Krebsvorläufern begünstigen“, resümiert Michael Sigal. Die Signalwege bei der Interaktion zwischen dem Immunsystem und Stammzellen, die auch für andere Organe als den Magen bedeutsam sein könnten, stellen somit einen Ansatzpunkt für neue Therapien – sowohl in der Krebsvorsorge als auch in der regenerativen Medizin – dar.
Weitere Informationen
Literatur
Marta Kapalczynska et al (2022): “BMP feed-forward loop promotes terminal differentiation in gastric glands and is interrupted by H. pylori-driven inflammation”, in: Nature Communications, DOI: 10.1038/s41467-022-29176-w
Download
Mit Helicobacter-Bakterien infiziertes Magengewebe. Sich teilende Zellen sind grün, Zellkerne blau dargestellt. © Charité / Michael Sigal
Kontakt
Professor Michael Sigal
Charité – Universitätsmedizin Berlin Campus Charité Mitte und Campus Virchow-Klinikum
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Tel.: +49 (0) 30 450 614 055
michael.sigal@charite.de
- Max-Delbrück-Centrum für Molekulare Medizin (MDC)
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.